Видео:Распределение Максвелла — Больцмана (часть 6) | Термодинамика | ФизикаСкачать

Площадь ограниченной кривой распределения максвелла
§4 Закон Максвелла о распределении по скоростям и энергиям
Закон распределения молекул идеального газа по скоростям, теоретически полученный Максвеллом в 1860 г. определяет, какое число dN молекул однородного ( p = const) одноатомного идеального газа из общего числа N его молекул в единице объёма имеет при данной температуре Т скорости, заключенные в интервале от v до v + dv .
Для вывода функции распределения молекул по скоростям f ( v ) равной отношению числа молекул dN, скорости которых лежат в интервале v ÷ v + dv к общему числу молекул N и величине интервала dv
Максвелл использовал два предложения:
а) все направления в пространстве равноправны и поэтому любое направление движения частицы, т.е. любое направление скорости одинаково вероятно. Это свойство иногда называют свойством изотропности функции распределения.
б) движение по трем взаимно перпендикулярным осям независимы т.е. х-компоненты скорости 



Считается также, что газ состоит из очень большого числа N тождественных молекул находящихся в состоянии беспорядочного теплового движения при одинаковой температуре. Силовые поля на газ не действуют.
Функции f ( v ) определяет относительное число молекул dN ( v )/ N скорости которых лежат в интервале от v до v + dv (например: газ имеет N = 10 6 молекул, при этом dN = 100
молекул имеют скорости от v =100 до v + dv =101 м/с ( dv = 1 м 

Используя методы теории вероятностей, Максвелл нашел функцию f ( v ) — закон распределения молекул идеального газа по скоростям:
f ( v ) зависит от рода газа (от массы молекулы) и от параметра состояния (от температуры Т)
f ( v ) зависит от отношения кинетической энергии молекулы, отвечающей рассматриваемой скорости 










X >=
Тогда средняя арифметическая скорость молекул
и интегрируя по частям получили
Скорости, характеризующие состояние газа
§5 Экспериментальная проверка закона распределения Максвелла — опыт Штерна

Изображение щели получается размытым. Исследуя толщину осаждённого слоя, можно оценить распределение молекул по скоростям, которое соответствует максвелловскому распределению.
§6 Барометрическая формула
Распределение Больцмана
До сих пор рассматривалось поведение идеального газа, не подверженного воздействию внешних силовых полей. Из опыта хорошо известно, что при действии внешних сил равномерное распространение частиц в пространстве может нарушиться. Так под действием силы тяжести молекулы стремятся опуститься на дно сосуда. Интенсивное тепловое движение препятствует осаждению, и молекулы распространяются так, что их концентрация постепенно уменьшается по мере увеличения высоты.
Выведем закон изменения давления с высотой предполагая, что поле тяготения однородно, температура постоянна и масса всех молекул одинакова. Если атмосферное давление на высоте h равно p , то на высоте h + dh оно равно p + dp (при dh > 0, dp p уменьшается с увеличением h ).




Тогда
Из уравнения Менделеева-Клапейрона.
Пропотенцируем данное выражение (
Барометрическая формула, показывает, как меняется давление с высотой
При

n 
n 0 



§7 Опытное определение постоянной Авогадро
Ж. Перрен (французкий ученый) в 1909 г. исследовал поведение броуновских частиц в эмульсии гуммигута (сок деревьев) с размерами осматривались с помощью микроскопа, который имел глубину поля — 1мкм. Перемещая микроскоп в вертикальном направлении можно было исследовать распределение броуновских частиц по высоте.
Применив к ним распределение Больцмана можно записать
n = 
m — масса вытесненной жидкости:
Если n 1 и n 2 концентрация частиц на уровнях h 1 и h 2 , а k = R / NA , то
NA=
Значение 

Видео:Распределения Максвелла. Часть 1. Скорости газовых молекул. График распределения МаксвеллаСкачать

Закон распределения молекул по скоростям
С помощью закона распределения молекул по скоростям мы можем описать, как именно в макроскопической системе происходит распределение частиц (при условии ее нахождения в термодинамическом равновесии). Такое распределение называется стационарным, и воздействия внешних сил на систему при этом не происходит.
Данный закон распространяется как на жидкости, так и на газы, если на них действуют законы классической механики. Если мы знаем, как именно распределяются молекулы по своим скоростям, значит, мы можем ответить, какой объем молекул имеет определенную скорость в условиях заданной температуры в равновесном состоянии.
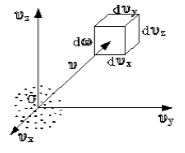
Чтобы лучше объяснить данный вопрос, начнем с введения такого понятия, как пространство скоростей. Оно изображено схематически на рисунке 1 .
Мы видим, что в декартовой системе координат здесь отмечены именно проекции скоростей, а не координаты. Тогда исходный вопрос можно переформулировать так: «Как именно будут распределяться молекулы в пространстве скоростей»?
Очевидно, что данное распределение не будет равномерным. Если в пространстве мы выделим параллелепипед, имеющий объем d ω = d υ x d υ y d υ z , то в нем окажется d N υ молекул. Обозначим буквой N число молекул газа, тогда f ( v ) будет некоторой функцией скорости.
Видео:Рассмотрение темы: "Распределение Максвелла"Скачать

Распределение Максвелла
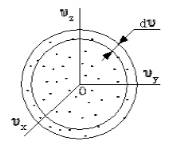
Поскольку, как мы уже отмечали, газ находится в равновесном состоянии, то направления движений частиц являются равноправными. Значит, допустимо считать, что в пространстве скоростей распределение молекул является симметричным и имеет сферическую форму.
Определим, из скольких молекул состоит шаровой слой d υ . Разделим найденное выше число на количество частиц ( N ) и получим вероятность d W υ того, что пределы модуля скорости молекулы равны υ — υ + d v .
Здесь F ( v ) является функцией распределения вероятности значения v . Впервые данная функция теоретически была получена Д. Максвеллом.
Таким образом, закон распределения молекул по модулям скоростей имеет следующий вид:
d N υ = N 4 π m 0 2 πkT 3 2 e x p — m 0 υ 2 2 k T υ 2 d υ .
Здесь υ = υ x 2 + υ y 2 + υ z 2 , масса молекулы равна m 0 , а k – постоянная Больцмана.
По проекциям скоростей распределение Максвелла может быть записано так:
d N = N f υ x f υ y f υ z d υ x d υ y d υ z .
Важно учесть, что:
f υ i = m 0 2 πkT 1 2 e x p — m 0 υ i 2 2 k T ( i = x , y , z ) .
Параметры υ x , υ y , υ z означают проекции скоростей молекул на оси координат.
Также возможен следующий вариант записи распределения Максвелла:
d N = N 4 π υ v e r 3 e x p — υ υ v e r 2 υ 2 d υ .
Здесь υ υ e r обозначает наиболее вероятную скорость движения молекулы.
Видео:Математика без Ху!ни. Определенные интегралы, часть 3. Площадь фигуры.Скачать

Как выглядит распределение Максвелла на графике
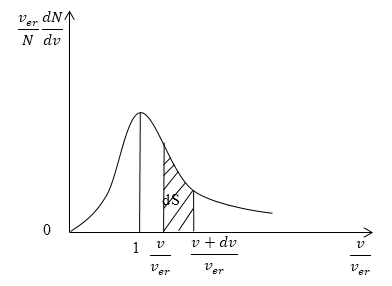
Кривая распределения молекул по скоростям на графике выглядит так:
При этом доля тех молекул, которые движутся со скоростями в интервале от υ до υ + d υ будет пропорциональна площади d S , которая на графике обозначена штриховкой.
Скорости всех молекул принадлежат интервалу от нуля до плюс бесконечности, значит, будет верным равенство:
∫ 0 ∞ f ( υ ) d υ = 1 .
Оно называется условием нормировки функции распределения.
Следовательно, распределение Максвелла по скоростям имеет зависимость от температуры газа и массы его молекул. Объем и давление можно не учитывать.
Условие: вычислите, какова будет наиболее вероятная скорость молекул газа при температуре Т в равновесном состоянии.
Нам потребуется распределение Максвелла (распределение по модулям скоростей).
d N υ = N 4 π m 0 2 π k T 3 2 e x p — m 0 υ 2 2 k T υ 2 d υ .
Максимум функции будет соответствовать самой вероятной скорости. Дифференциация выражения по скорости и сравнение ее с нулем даст нам следующий результат:
d N υ d υ = N 4 π m 0 2 πkT 3 2 2 υ υ e r e x p — m 0 υ υ e r 2 2 k T — υ υ e r 2 m 0 2 υ υ e r 2 k T e x p — m 0 υ υ e r 2 2 k T = 0 ;
2 υ υ e r — υ υ e r 2 m 0 2 υ υ e r 2 k T = 0 → 1 — υ υ e r 2 m 0 2 k T = 0 → υ υ e r 2 = 2 k T m 0 .
υ υ e r = 2 k T m 0 .
Ответ: наиболее вероятно, что скорость газа будет равна υ υ e r = 2 k T m 0 .
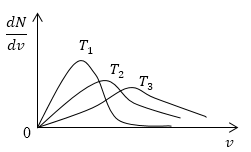
Условие: изобразите кривые распределения скоростей молекул газа при росте температуры Т .
Возьмем формулу наиболее вероятной скорости из предыдущей задачи.
υ υ e r = 2 k T m 0
Понятно, что чем больше будет температура, тем выше будет скорость молекул, т.е. произойдет смещение максимума в сторону больших скоростей. Поскольку площадь под кривой распределения является постоянной величиной, кривые на графике будут показаны следующим образом:
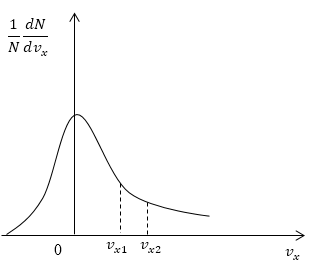
Условие: дан график функции, по которой молекулы будут распределяться с учетом проекций скорости υ x . Сопоставьте количества молекул, проекции скорости которых будут принадлежать интервалам от нуля до υ x 1 и от υ x 1 до υ x 2 .
Как мы уже указывали ранее, доля молекул газа, скорости которых лежат в первом интервале, будет пропорциональна площади фигуры, образуемой кривой распределения, вертикальной осью 0 1 N d N d υ x и вертикальным пунктиром, перпендикулярным оси проекций. Во втором интервале нужная доля будет пропорциональна площади фигуры, ограниченной кривой распределения и вертикальной прямой, параллельной оси о х и проходящей через точку υ x 1 . Очевидно, что площадь первой фигуры будет меньше площади второй. Значит, и молекул, проекции скоростей которых лежат в первом интервале, будет меньше, чем во втором.
Ответ: молекул, имеющих проекции скорости в интервалах: от 0 до υ x 1 меньше, чем молекул, имеющих проекции скорости в интервалах: от υ x 1 до υ x 2 .
Видео:Урок 153. Распределение молекул по скоростямСкачать

МА́КСВЕЛЛА РАСПРЕДЕЛЕ́НИЕ
В книжной версии
Том 18. Москва, 2011, стр. 574
Скопировать библиографическую ссылку:
МА́КСВЕЛЛА РАСПРЕДЕЛЕ́НИЕ, функция распределения по скоростям микрочастиц (атомов или молекул) макроскопич. физич. системы, находящейся в тепловом равновесии со своим окружением при заданной абсолютной температуре Т в отсутствие внешнего поля. М. р. справедливо для частиц, описываемых в рамках классич. механики, причём оно не зависит от взаимодействия между частицами и обусловлено лишь наличием взаимных столкновений между ними; в частности, М. р. имеет место для броуновского движения частиц, взвешенных в жидкости или газе.
🎥 Видео
22. Распределение МаксвеллаСкачать

Урок 155. Изучение распределения МаксвеллаСкачать

Лекция №9 "Распределение Максвелла"Скачать

Опыт Штерна. Распределение МаксвеллаСкачать

24. Задачи на распределение МаксвеллаСкачать

Караваев В. А. - Молекулярная физика - Распределение МаксвеллаСкачать
Криволинейная трапеция и ее площадь. 11 класс.Скачать

Александр Чирцов про функции распределения МаксвеллаСкачать

Семинар №14 Распределения Максвелла, Больцмана Тепловые машиныСкачать

Модель распределения Больцмана.Скачать

Распределения Максвелла.Скачать

Найти площадь фигуры, ограниченной линиями. Пример 1.Скачать
Применение определенного интеграла при решении геометр. и физических задач. Практ. часть. 11 класс.Скачать

Основы молекулярной физики | распределение молекул по ск. | 2 | распределение Максвелла | для взр.Скачать

Билеты №32, 33 "Уравнения Максвелла"Скачать