- Анодная площадь при цинковании с использованием титановых корзин
- Расчет площади покрываемых изделий в гальванике
- Вы здесь
- Что такое гальваника? Теоретические основы нанесения гальванических покрытий.
- 1. Понятие об электролизе. Принципиальная схема электролизера.
- 2. Гальваника и закон Фарадея. Выход по току. Метод расчета толщины осаждаемого покрытия.
- 3. Потенциал электрода. Перенапряжение (поляризация).
- 4. Напряжение на электролизере.
- 5. Лимитирующие стадии электродной реакции. Поляризационная кривая. Предельный диффузионный ток. Концентраторы тока.
- 6. Одновременное протекание реакций на электроде. Выделение металла одновременно с газом. Сплавообразование.
- 6.1 Выделение водорода одновременно с осаждением металла на катоде.
- 6.2 Одновременное выделение двух и более металлов или металла и неметалла (сплавообразование).
- 7. Простые и комплексные электролиты в гальванотехнике.
- 📹 Видео
Видео:Как рассчитать площадь будущего дома.Скачать

Анодная площадь при цинковании с использованием титановых корзин
Мы переходим на линии цинкования на новые аноды (цилиндрические, диаметр — 50мм, с внутренним отверстием) и будем делать под них титановые корзины. Аноды будут располагаться в корзине следующим образом: стороной с отверстием обращены к барабану, 10 шт. анодов один над другим. (Как в книге Окулова В.В. Цинкование. Техника и технология. стр. 176). Посоветуйте пожалуйста, как правильно рассчитать анодную площадь. В данный момент мы ещё работаем на рубленных анодах и площадь считаем: сторона анодов обращённая к барабану учитывается в полном объёме, а сторона анодов обращённая к стенке ванны на 1/2. При этом площадь самой корзины я до этого не учитывала.
Заранее спасибо. С уважением, Соловьёва С.А.
Ваше решение применять для цинкования цилиндрические аноды считаю правильным. Для определения площади анодов следует посчитать полную поверхность цилиндрических анодов, поверхность стальной корзины (или титановой, если кислый электролит) можно не учитывать. Вы прекрасно понимаете, что анодная поверхность для растворимых анодов — это «от лукавого». Считать ее надо лишь в исходной позиции, когда вы планируете перейти на новые аноды с тем, чтобы определиться с количеством корзин и засыпаемых штучных анодов. Обычно, анодная поверхность должна быть в 1,5-2 раза больше катодной для нормального растворения цинка. В дальнейшем, при работе поверхность анодов будет всегда уменьшаться и считать ее не имеет никакого смысла.
Критерием правильной работы анодов является концентрация цинка в электролите. Если она уменьшается, то следует добавить анодных цилиндров (шаров) в корзину, чтобы избежать их пассивацию при анодном растворении. Надо также учитывать химическое растворение цинка в щелочном электролите во время пауз между периодами покрытия деталей. Впрочем, не буду повторяться, в книге об этом написано.
Видео:Как правильно рассчитать площадь дома, зданияСкачать

Расчет площади покрываемых изделий в гальванике
Видео:Что такое магниевый анод, для чего он нужен, и как часто их необходимо менять?Скачать

Вы здесь
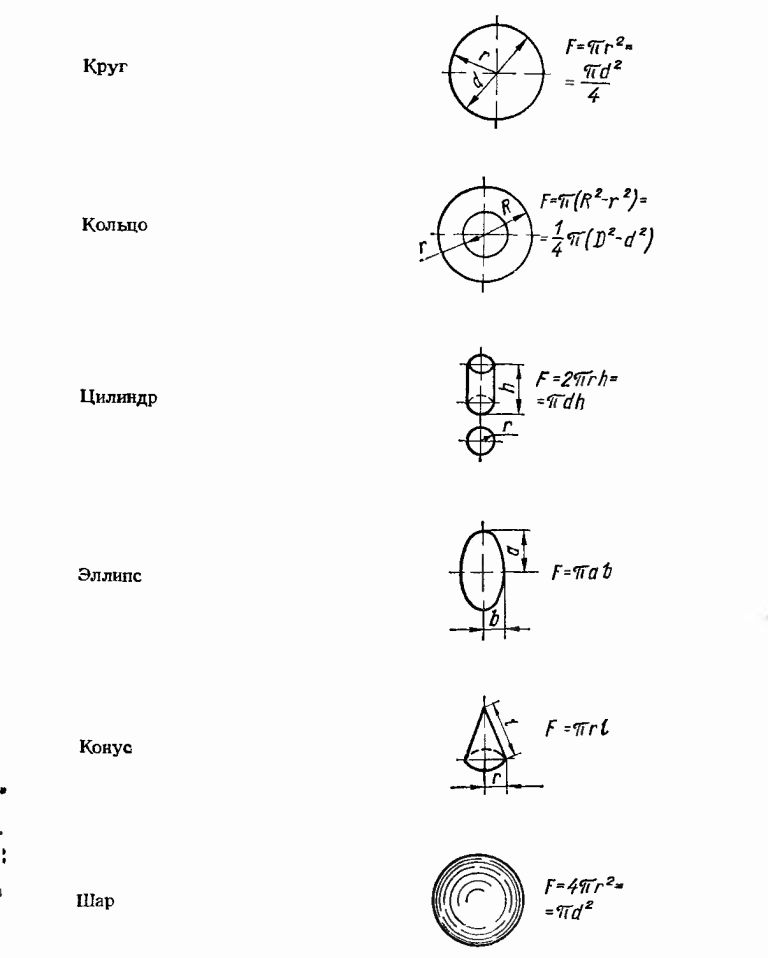
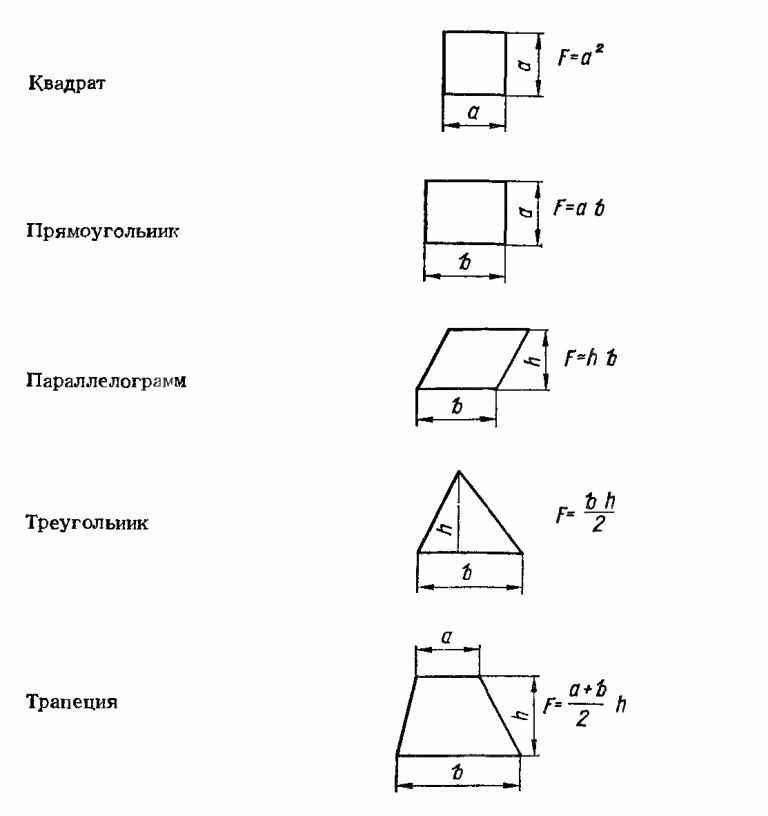
Для того что бы расчитать площадь анодов и необходимый ток.необходимо знать площадь поверхности покрываемого изделия.Для этого любую деталь можно разложить на несколько простых геометрических фигур и расчитать прибегнув к несложным формулам.После площади этих фигур следует просуммировать.
У нас единый многоканальный номер 8-351-701-01-77
Овсейчук Валерий Васильевич,
директор — 8-908-571-59-17
Матвеев Николай Иванович,
инженер-технолог — 8-912-323-10-30
Матвеев Евгений,
мастер участка цинк-алюминиевых покрытий — 8-908-938-88-74
Видео:Как запомнить анод и катод диода. How to remember the anode and the cathode of the diode.Скачать

Что такое гальваника? Теоретические основы нанесения гальванических покрытий.
Содержание:
Видео:Площадь стен | Как посчитать квадратные метрыСкачать

1. Понятие об электролизе. Принципиальная схема электролизера.
Гальваника — это осаждение металла или оксида на поверхности изделия для придания ему новых функциональных свойств или улучшения внешнего вида. Гальваника выполняется под действием электрического тока, отсюда возникает понятие «электролиз».
Электролиз с практической точки зрения является комплексом окислительно-восстановительных реакций, протекающих под действием электрического тока в электролите.
Электролит — это среда (для классической гальваники — водный раствор), обладающая ионной электрической проводимостью. Проще говоря — жидкость, способная проводить через себя электрический ток. Электрический ток проводится в основном за счет сольватированных в растворителе ионов. Сольватация является своего рода «растаскиванием» ионов из прочной кристаллической решетки твердого вещества диполями воды. В результате каждый ион становится окружен некоторым количеством молекул воды и в этом виде передвигается либо к положительному, либо к отрицательному электроду.
Когда через электролит пропускается электрический ток, то первоначально происходит направленное движение электронов в металлических проводниках. От анода электроны переходят к катоду, в результате чего на аноде образуется избыточный положительный заряд. При включенной электрической цепи с внешним источником тока на растворимом аноде будет происходить отнятие электронов у атомов металла-основы анода, а на нерастворимом — отнятие электронов у тех анионов, которые находятся прианодной области. На катоде же появляется избыточный отрицательный заряд за счет скопившихся на нем электронов. К положительному аноду начинают движение противоположно заряженные анионы, а к катоду — катионы. При этом достигнув электродов они могут претерпевать определенные химические превращения.
Проходящий через электролит ток обычно постоянный, хотя иногда он может быть и переменным или изменяться по определенной функции. В любом случае, мы всегда сможем выделить катодный (восстановление) и анодный (окисление) процессы.
Электролиз не обязательно должен происходить только в водных растворах. Существуют также неводные электрохимические системы на основе органических (в основном апротонных) растворителей, солевых расплавов и даже твердых электролитов, однако их применение в промышленности для получения металлических покрытий ограничено, а в случае твердых электролитов — вообще невозможно.
В гальванике, исходя из вышеприведенной схемы, может быть три варианта организации процесса:
1. Электролиз с растворимыми анодами. Металл анода растворяется и его ионы переходят в раствор, а на катоде эти же ионы восстанавливаются и осаждается металлическое покрытие. Примеры такого процесса — цинкование, меднение, никелирование и т.п.
2. Электролиз с нерастворимыми анодами. Анод не растворяется, на нем происходит побочная реакция, например, выделение кислорода. На катоде происходит восстановление металла, ионы которого подтягиваются из электролита. Происходит непрерывное снижение концентрации ионов металла в растворе.
3. Анодирование — получение оксидного покрытия на детали, завешенной в ванну анодом, на катоде идет выделение водорода.
Устройство для проведения электролиза называется электролизером. Небольшой лабораторный электролизер принято называть ячейкой, в то время как промышленная установка будет называться гальванической ванной.
Схема простейшего электролизера (рисунок 1 и 2) всегда включает в себя:
- электролит, через который протекает электрический ток;
- катод(ы) — покрываемые детали (отрицательный электрический полюс, на котором происходит процесс принятия электронов — восстановления).
- Катод, на который наносится покрытие также может называться подложкой или основой, а покрытие на катоде — осадком;
- аноды — противоэлектроды (положительный электрический полюс, на котором происходит процесс отдачи электронов — окисления);
- источник электрического тока.
В случае нанесения анодного оксидного покрытия, например, на алюминии (процесс анодирования), покрываемые изделия находятся на аноде, а катоды выполняют роль противоэлектродов.
Электролизер может комплектоваться и дополнительным оборудованием:
- нагреватели;
- системы перемешивания;
- системы фильтрации;
- бортовые отсосы;
- крышки;
- датчики технологических параметров (температуры, рН, уровень, потенциал, концентрация компонентов и т.п.), дозаторы и другие средства автоматизации.
Ри сунок 1 — Принципиальная схема электролизера
Рису нок 2 — Реальный электролизер (гальваническая ванна блестящего цинкования из щелочного цинкатного электролита).
Видео:Как посчитать площадь комнаты в квадратных метрах – снято на видеоСкачать

2. Гальваника и закон Фарадея. Выход по току. Метод расчета толщины осаждаемого покрытия.
Первоочередной задачей при штатной работе гальванического цеха является получение на изделиях покрытий заданной толщины и структуры с минимально возможными экономическими затратам. Для вычисления толщины покрытия, полученного во время электролиза при заданном токе необходимо использовать закон Фарадея — основной количественный закон электролиза.
Закон Фарадея связывает массу выделявшегося на электроде вещества и количество пропущенного через электролит электричества. Применительно к гальванике закон Фарадея можно представить следующим образом:
где:
m — масса выделившегося на катоде металла, г;
A — Атомная масса выделяющегося металла;
z — Количество электронов, участвующих в процессе восстановления металла;
F — Число Фарадея — 96500 Кл*моль -1
I — Общий ток, пропущенный через электролит, А;
t — Общее время электролиза;
Вт — Выход по току.
Выход по току — доля электрического тока, потраченная на прохождение целевой электрохимической реакции. Выход по току характеризует только электрохимический процесс т.е., например, при анодном растворении меди в сернокислом электролите выход по току близок к 100%, однако еще 5% может добавляться за счет химического растворения меди в электролите. В итоге, рассчитанный выход по току может формально быть 105% за счет химического растворения меди.
Соотношение катодного и анодного выхода по току определяет стабильность электролита. Очевидно, что если при электроосаждении металла с растворимыми анодами катодный выход по току будет больше, чем анодный, то электролит будет постепенно обедняться по ионам осаждаемого металла, а если наоборот — то обогащаться. И то и другое будет уменьшать стабильность электролита.
При рассмотрении анодного процесса в гальванике нам будет интересна масса растворившегося на аноде металла (это необходимо для примерной оценки срока службы анодов). При рассмотрении же катодного процесса нам будет интересна не столько масса осаждаемого покрытия (за исключением драгметаллов), сколько его толщина. Поэтому, исходя из закона Фарадея мы можем вывести зависимость толщины покрытия от плотности тока.
Плотность тока — важный параметр работы гальванической установки. Она представляет собой отношение общего тока, протекающего через электрод к площади электрода:
где:
i — плотность тока, А/дм 2 ;
I — Общий ток, пропущенный через электролит, А;
S — Площадь электрода, дм 2 ;
Отметим, что наиболее часто площадь деталей в гальваностегии выражается в квадратных дециметрах, а плотность тока, соответственно, в амперах на дециметр квадратный. Реже применяется отношение к квадратному сантиметру (научные экспериментальные работы) и квадратному метру (например, при оцинковке стальной ленты). Использование дециметров в гальванике удобно тем, что в этом случае получаются не слишком большие и не слишком малые величины.
Очевидно, что в зависимости от рассматриваемого электрода плотность тока может быть катодной и анодной (iк и iа). От плотности катодного тока зависит скорость нанесения и, во многом, структура покрытия, а от плотности анодного — состояние анодов (активное, в котором происходит их растворение, либо пассивное, когда вместо растворения металла протекают побочные реакции, в основном выделение кислорода).
Важно понимать, что площадь электрода S может быть геометрической и реальной.
Геометрическая площадь (и связанная с ней геометрическая плотность тока) высчитывается исходя из геометрических размеров детали по стандартным математическим формулам.
Реальная площадь (и реальная плотность тока) может быть определена исходя из шероховатости и микрорельефа поверхности. Так, сравнив фотографии серебряного покрытия на рисунке 3 (А и Б) становится очевидно, что площадь поверхности пластинки на самом деле в 2-3 раза больше, чем просто произведение длины на ширину. Следует учитывать реальную площадь при гальваническом покрытии деталей с высокой шероховатостью поверхности, например, после пескоструйной или дробеструйной обработки.
Рисунок — 3 — Микроизображение серебряного покрытия на латунной подложке, полученного гальванически из диметилгидантоинового электролита, А — общая фотография, Б — микроизображение на электронном микроскопе в режиме топографического контраста с увеличением х5000.
Вернемся к Закону Фарадея и заменим в уравнении ток I на плотность тока i, а массу выразим через плотность осаждаемого металла:
Величина V/S представляет собой искомую толщину покрытия δ, если условно принять покрытие за параллелепипед, то:
Заметим, что толщина покрытия в гальваностегии обычно выражается в микрометрах (мкм).
Расчет толщины гальванического покрытия на практике обычно производится приблизительно по справочными данными о средней толщине покрытия, осаждаемого из данного электролита при данной плотности тока. Эти данные содержатся в ГОСТ 9.305-84, либо в отдельных техпроцессах, поставляемых вместе с фирменными органическими добавками к электролитам. Например, в таблице 1 приведены усредненные данные для гальванического цинкования из щелочного цинкатного электролита с двумя блескообразователями.
Точный расчет по формуле на практике лишен смысла, т.к. невозможно точно определить реальную плотность тока и реальный выход по току на каждом участке сложнопрофильной поверхности. Поэтому расчет всегда будет носить приближенный оценочный характер. В любом случае, перед выбором режима осаждения покрытия отработка и измерение толщины производится на опытных образцах деталей.
Таблица 1 — Примерное соответствие выхода по току и толщины осаждаемого цинкового покрытия от плотности катодного тока
Плотность тока, А/дм 2
Скорость осаждения, мкм/мин
Видео:Куда течёт ток? Анод. Катод.Скачать

3. Потенциал электрода. Перенапряжение (поляризация).
Металлические электроды, опущенные в раствор электролита, содержащего одноименные с металлом ионы, обладают характеристикой, называемой равновесным потенциалом.
В гальванике равновновесный потенциал электрода характеризует динамическое равновесие между ионами металла, выходящими из кристаллической решетки электрода в раствор и одноименными ионами в растворе, стремящимися войти в кристаллическую решетку электрода. Скорость обмена характеризуется так называемым током обмена i0. Такая система реализуется в любом электролите для нанесения покрытий с использованием растворимых металлических анодов, например, когда мы загружаем медные аноды в электролит сернокислого меднения, состоящий из сульфата меди и серной кислоты.
При использовании нерастворимых анодов или при опускании анода в раствор, в котором отсутствую одноименные ему ионы, на нем будет реализовываться стационарный потенциал.
Равновесный потенциал привязан к величине стандартных потенциалов металлов (табличные значения) уравнением Нернста:
где:
Е — Равновесный электродный потенциал, В;
Е0 — стандартный электродный потенциал, В;
R — Универсальная газовая постоянная, 8,31 Дж/(моль*К);
Т — абсолютная температура, К;
n- число электронов, участвующих в процессе;
F — постоянная Фарадея, равная 96500 Кл*моль -1 ;
aOx и aRed — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакциях.
Если подставить в уравнение значения R и F, перейти к десятичным логарифмам и принять, что температура 298 К, то уравнение Нернста можно преобразовать в следующий вид:
Когда мы приложим к электродам установки разность потенциалов (проще говоря подключим источник постоянного тока) потенциал электрода будет смещаться от равновесного значения. В гальванике принято считать, что смещение катодного потенциала идет в отрицательную область, а анодного — в положительную, хотя это и условно (можно принять и обратное отношение знаков).
Смещение электродных потенциалов от равновесного значения под действием приложенного извне напряжения называется поляризацией, разница между равновесным потенциалом и потенциалом под током — перенапряжением. Поляризация и перенапряжение, по сути, синонимы. Степень зависимости плотности тока от потенциала называется поляризуемость.
Перенапряжение обозначается как ηК и ηА соответственно для обозначения катодного и анодного процесса.
Наглядно эти вопросы будут разъяснены при рассмотрении поляризационных кривых.
Отметим, что чем выше перенапряжение выделения металла на катоде, тем более мелкокристаллическим будет покрытие. При осаждении покрытий стремятся получать как можно более мелкокристаллические осадки. Обоснование этого будет дано далее.
Следует также запомнить общее правило: на катоде идут преимущественно электроположительные процессы, на аноде — электроотрицательные.
Видео:Цилиндр - расчёт площади, объёма.Скачать

4. Напряжение на электролизере.
Для того, чтобы электрический ток прошел через электролизер, необходимо приложить определенное напряжение. При постоянной величине электрического тока I, чем выше сопротивление R в узлах электролизера, тем выше требуется напряжение U. Произведение U*I называется мощностью W, измеряемой в кВт. Произведение мощности на время (в часах) называется киловатт-часами и характеризует затраты электричества на проведение процесса. Следовательно, при прочих равных условиях, необходимо стремиться снизить напряжение на ванне.
Напряжение на работающем электролизере складывается из следующих величин:
- Uреакции — напряжение, требуемое для прохождения целевых реакций (осаждение покрытия, растворение анода и т.д.). Более правильно — это сумма обратимого напряжения разложения (разность равновесных или стационарных потенциалов катода и анода в данном электролите), катодной и анодной поляризации ή;
- Uтв проводники — напряжение, требуемое для прохождения электрического тока по твердым проводникам: покрываемым деталям, анодам, шинам, подвескам, проводам и т.д.
- Uконтакты — падение напряжения во всех контактах: места подключения проводов к источнику тока, места контакта проводов с шинами, шины с подвеской или анодными крючками, подвески и покрываемых деталей, анодных крючков и анодов;
- Uэлектролит — падение напряжения в электролите, определяющееся электропроводностью электролита;
- Uдиафр — падение напряжения в анодных чехлах, диафрагмах, колоколах, барабанах.
Общее сопротивление работающей гальванической ванны можно, таким образом, выразить формулой:
- Как видно из формулы, чтобы снизить сопротивление на работающей ванне нужно:
- использовать твердые проводники с минимальным сопротивлением и достаточным сечением. При прохождении по ним тока (при недостаточном сечении) они могут разогреваться, что дополнительно повысит их сопротивление.
- своевременно чистить все перечисленные выше электрические контакты. Использовать максимально коррозионно-стойкие материалы.
- своевременно корректировать электролит и соблюдать режим электролиза. При прохождении электрического тока через электролит его температура может расти, что увеличит его электропроводность, в отличие от твердых тел.
- по возможности не использовать чехлы и диафрагмы (при цинковании, например, анодные чехлы будут лишними, а вот при никелировании на подвесках — незаменимыми).
Видео:Найдите площадь треугольника на рисунке ★ Два способа решенияСкачать

5. Лимитирующие стадии электродной реакции. Поляризационная кривая. Предельный диффузионный ток. Концентраторы тока.
Для того, чтобы иону металла восстановиться и осадиться на катоде ему необходимо подойти к поверхности электрода из объема раствора, разрядиться и встроиться в кристаллическую решетку покрытия. Все эти процессы характеризуются определенной скоростью. Стадия, имеющая минимальную скорость будет тормозить всю реакцию. Такая стадия будет называться лимитирующей (замедленной) и будет контролировать электрохимический процесс.
В электрохимической кинетике скорость процесса может контролироваться замедленной диффузией (переносом) разряжающихся ионов из глубины раствора к поверхности катода, их замедленным разрядом (переходом иона в металл) или смешанной кинетикой, когда при определенных потенциалах замедленной будет диффузия ионов, а при других — их замедленный разряд. Также существуют и другие лимитирующие стадии — замедленная кристаллизация и замедленная промежуточная химическая реакция.
От того, какая стадия процесса является лимитирующей будет зависеть вид поляризационной кривой — зависимости плотности тока от потенциала электрода.
На рисунке 4 представлены типичные виды поляризационных кривых.
Отметим, что в повседневной гальванотехнике поляризационные кривые в рабочих электролитах снимаются редко, поэтому детальное изучение кинетики электрохиимических реакций мы опустим, оставив это курсу теоретической электрохимии.
Рассмотрим прикатодное пространство в электролите при включении внешнего тока (рисунок 5).
Рисунок 4 — Т ипичные виды поляризационных кривых: А — замедленная диффузия, Б — замедленный разряд, В — смешанная кинетика.
Рисунок 5 — Схема приэлектродного пространства в момент включения внешнего тока (зависимость концентрации ионов С от расстояния до катода L), где i0
Ток обмена характеризует процесс перехода ионов металла из кристаллической решетки катода в раствор и обратно. Как только будет включен источник тока разряжающихся ионов в прикатодном слое начнет падать. Одновременно с этим из глубины электролита за счет диффузии будет происходить поступление новых ионов с определенной скоростью.
Если скорость диффузии будет меньше скорости разряда ионов, то концентрация разряжающихся ионов в приэлектродном пространстве с ростом плотности тока будет продолжать уменьшаться. При определенной плотности тока все подходящие из глубины раствора ионы будут сразу же разряжаться на катоде. Данная плотность тока будет называться предельным током. Увеличить скорость электроосаждения мы теперь уже не сможем, т.к. новые ионы просто не будут успевать подходить из глубины электролита к поверхности катода. Важно знать, что для любой реакции может быть достигнут предельный ток, когда скорость этой реакции достигнет предельного значения. В этом случае на поляризационной кривой будет получена площадка, параллельная оси потенциалов (т.е. оси х).
Отметим, что площадка предельного тока может носить диффузионный характер, либо, реже, кинетический (соответственно возникают термины предельного диффузионного тока и предельного кинетического тока).
Предельный диффузионный ток (id) — ток, при котором скорости подвода ионов разряжающегося элемента (диффузии из объема электролита) уже не хватает для дальнейшего увеличения скорости электрохимической реакции восстановления данных ионов.
Предельный кинетический ток (iк) — ток, при котором скорость процесса полностью ограничивается скоростью медленной химической реакции, которая входит в суммарный электродный процесс (потеря комплексной разряжающейся частицей лиганда, димеризация продукта разряда иона и т.д.), а также скоростью проникновения разряжаемых частиц через слой адсорбированных на поверхности катода органических соединений (ПАВ: блескообразователей, выравнивающих добавок).
При перемешивании электролита будет увеличиваться величина предельного диффузионного тока и не будет изменяться величина предельного кинетического.
Понятие предельного диффузионного тока является крайне важным в гальванотехнике, т.к. в большинстве случаев при достижении такого тока получить компактное покрытие уже не удается — осаждается металл порошкообразной (дендритной) структуры. Таким образом возникает понятие рабочей плотности тока или, чаще, рабочего диапазона плотностей тока.
Диапазон рабочих плотностей тока — область плотностей тока, в которой можно получить качественное покрытие требуемой структуры и с требуемыми свойствами. Например, при меднении из сернокислого электролита без перемешивания рабочий диапазон составляет обычно 1-2 А/дм 2 . При меньшем токе покрытие может стать матовым, а при большем — порошкообразным. Особенно характерно диапазон рабочих плотностей тока проявляется при хромировании.
Принято считать, что рабочие плотности тока в гальванических процессах располагаются значительно ниже величин предельного диффузионного тока. Однако, есть примеры покрытий, осаждающихся на предельном токе — например, покрытие блестящим сплавом олово-висмут из сернокислого электролита с рядом органических добавок. Так, считается, что бескообразующие органические добавки, способствующие получению компактного блестящего гладкого покрытия, начинают действовать только на токах близких к предельным, тогда как при низких плотностях тока покрытие получается пористым шероховатым и мажущимся.
Учитывая сложную геометрию покрываемых деталей в гальванике важно понимать, что предельный ток может реализовываться не на всем электроде целиком, а на отдельных его частях («концентраторах тока») — острых кромках, выступах, а также в случаях, когда глубина погружения детали меньше глубины погружения анода и т.д. (рисунок 6,7).
Рисунок 6 — Распределение силовых линий от более длинного анода к более короткому катоду, на котором имеются «концентраторы тока».
Рисунок 7 — Пример никелированной детали, на которой имеются углы — «концентраторы тока».
На таких местах будет образовываться так называемый «пригар» — участок покрытия темного, серого (вплоть до черного) цвета, имеющего порошкообразную структуру (рисунок 8).
Рисунок 8 — П ример микроструктуры порошкового медного покрытия на медной подложке.
Также, на таких участках может значительно повышаться рН за счет расходования ионов H+ на выделение газообразного водорода. В этом случае может достигаться рН гидратообразования для некоторых металлов. например, никеля, и мы увидим еще и отложения гидроксидов металла.
Если параллельно с осаждением металла на катоде идет выделение водорода (как это имеет место, опять же, при никелировании), то в местах реализации предельного диффузионного тока будет наблюдаться значительно большее газовыделение, чем на остальной поверхности катода. Учитывая крупнокристаллическую структуру покрытия и его плохое сцепление с основой в этих местах, а также значительную скорость его наращивания, выделяющийся водород может просто срывать крупные части покрытия (эффект старой краски, отслаивающейся от покрашенного изделия) вызывая брак всего изделия. Для увеличения значения предельного диффузионного тока и, соответственно, расширения рабочих плотностей тока, как уже говорилось ранее, производится перемешивание электролитов.
Видео:Что такое анодСкачать

6. Одновременное протекание реакций на электроде. Выделение металла одновременно с газом. Сплавообразование.
Случаи, когда при нанесении гальванического покрытия на электроде протекает только одна реакция довольно редки. Гораздо чаще происходит одновременно две и более реакции. Условием для одновременного протекания двух электрохимических процессов является максимальное сближение потенциалов их разряда. Можно классифицировать ситуации следующим образом:
- Восстановление (осаждение) металла одновременно с выделением водорода;
- Восстановление (осаждение) металла одновременно с одним или несколькими другими металлами, а также, иногда, неметаллами и органическими веществами.
Также в качестве побочных реакций могут выступать реакции неполного восстановления металла (Fe 3+ → Fe 2+ ), реакции восстановления оксидных пленок и т.п.
Как правило, все процессы осаждения металлов в гальванике идут с одновременным восстановлением примесей из раствора (посторонние металлы, сера, органика и т.п.), продукты восстановления которых встраиваются в покрытие и вызывают изменение его физико-механических свойств — положительное или отрицательное. Примером положительно влияющей примеси (можно назвать ее легирующим компонентом) является висмут в сплаве олово-висмут, дающий улучшение коррозионной стойкости, предотвращение эффекта «оловянной чумы», увеличение срока сохранения способности к пайке. Примером сплава с вредной примесью — никелевое покрытие, загрязненное медью (медь дает ухудшение прочности сцепления покрытия с основой, ухудшение внешнего вида — потерю блеска, образование грязно-серого покрытия, ухудшение защитных антикоррозионных свойств).
6.1 Выделение водорода одновременно с осаждением металла на катоде.
Выделение водорода одновременно с покрытием происходит, например, при никелировании, хромировании, цинковании из цинкатного электролита, лужении из кислого электролита и т.д. Выделение водорода усиливается при приближении к предельному диффузионному току.
Рассмотрим рисунок 8, на котором показаны поляризационные кривые одновременного выделения водорода и металла на катоде. При потенциале Е1 доля общего тока, приходящегося на выделение металла составляет примерно 2/3 общего тока, а выделения водорода — 1/3. При более отрицательном потенциале Е2 наоборот, доля тока осаждения металла составит 1/3 общего, а доля тока выделения водорода — 2/3. И чем более отрицательный потенциал мы будем задавать, тем больше будет доля тока выделения водорода в общей величине тока, пропущенного через электролизер.
Рисунок 8 — П оляризационные кривые одновременного выделения металла и водорода.
Выделение водорода при катодном осаждении металла практически всегда отрицательно сказывается на качестве покрытия. Тому есть несколько причин:
- Водород может проникать в покрытие и металлическую основу, вызывая «водородную хрупкость» металлов.
- Водород может задерживаться на поверхности металла, вследствие чего покрытие будет расти вокруг пузырька газа. В результате будет образовываться ямочка, иногда доходящая до подложки — «питтинг». Это особенно актуально для никелирования.
Рис унок 9 — Сх ема образования питтинга за счет пузырька водорода, прилипшего к покрытию
- Водород может создавать «газовые мешки», под которыми покрытия образовываться не будет (рисунок 10).
Рисунок 10 — Схема образования газовых мешков.
С другой стороны, очень редко водород может играть и положительную роль, например при щелочном цинковании из цинкатного электролита. Обильное выделение водорода в этом процессе позволяет доочистить поверхность покрываемых деталей от загрязнений и несколько улучшить прочность сцепления покрытия с основой в этом случае (здесь речь будет идти об «очищающем» действии электролита). Однако, не следует забывать и о том, что обильное выделение водорода одновременно с этим ухудшит физико-механические свойства покрытия за счет наводораживания и, соответственно, водородной хрупкости. Кроме этого, десорбирующийся из детали водород при сильно напряженном покрытии может вызывать появление отслоений в виде пузырей.
6.2 Одновременное выделение двух и более металлов или металла и неметалла (сплавообразование).
Сплавообразование может быть желательным и нежелательным. В первом случае мы целенаправленно хотим получить сплав с определенно заданными свойствами: олово-висмут, никель-фосфор и т.п. Во втором — мы не хотим получать сплав, но он образуется по причине особенностей техпроцесса или ошибок в нем. Так, при щелочном цинкатном цинковании с блескообразователями в покрытие может включаться до 1 % углерода из органических блескообразующих добавок. Изначально мы не хотим этого, но без введения органики в электролит покрытия требуемого качества мы не получим. Так же в никелевое покрытие, полученное из сульфатно-хлоридного электролита с органическими блескообразователями, встраивается сера. Таким образом, речь идет об особенностях техпроцесса. Однако, если электролит никелирования загрязнен медью, то включение меди в никелевое покрытие вызовет ухудшение его качества. Данного явления можно было бы избежать, т.к. медь попала в раствор из-за ошибки в техпроцессе (например, медные детали плохо промыли после подготовительных операций и остатки раствора травления попадали в ванну никелирования).
Для того, чтобы две электроактивных частицы одновременно восстановились на катоде нам необходимо максимально сблизить их потенциалы разряда. Этого можно достичь следующими способами:
- Связать одну из частиц в комплекс;
- Понизить концентрацию одного вещества, по сравнению с другим;
- Ввести ПАВ.
- Задать соответствующую плотность тока. Например, при осаждении бронзы (сплав медь-олово) в зависимости от плотности тока можно получать покрытие с различным содержанием олова — низкооловянную желтую бронзу или высокооловную белую бронзу из одного и того же электролита.
Видео:ЭЛЕКТРОЛИЗ катод анод ИОНЫСкачать

7. Простые и комплексные электролиты в гальванотехнике.
Традиционно в гальванике применяются простые и комплексные электролиты. Отличие состоит в том, в какой форме находятся ионы осаждаемого металла. Простые электролиты содержат сульфаты, нитраты, хлориды и т.п. и осаждаемый металл в них находится в форме простой соли. Соответственно, электролиты будут называться сульфатные, нитратные, хлоридные и т.п. Если используется смесь солей, то название будет двойным, тройным и т.д., например, сульфатно-нитратные, сульфатно-хлоридные.
В комплексном электролите ион осаждаемого металла связан в комплекс. Характеристикой комплексного электролита является константа нестойкости комплекса — чем она меньше, тем прочнее комплекс. В электролитах, комплекс которых имеет минимальную константу нестойкости, металл осаждается с наибольшим перенапряжением и, соответственно, покрытие получается наиболее мелкокристаллическим, а рассеивающая способность электролита и равномерность покрытия по толщине — максимальная. На практике наиболее прочные комплексы получаются обычно с цианид-ионами.
Для примера рассмотрим таблицу 4, в которой приведены значения констант нестойкости комплексов серебра и рисунок 14, где приведены некоторые поляризационные кривые осаждения серебра из различных комплексов. По рисунку 14 можно заметить, что чем меньше константа нестойкости комплекса, тем больше поляризация, что визуально выражается в более пологой кинетической кривой.
На практике часто применяются следующие виды комплексных электролитов: цианидные, аммиачные, пирофосфатные, роданистые, гидроксидные, борфтористоводородные. Другие комплексы применяют реже.
Таблица 4 — Значения констант нестойкости некоторых комплексов серебра.
📹 Видео
Площади фигур. Сохраняй и запоминай!#shortsСкачать

Определить площадь стен комнаты.Скачать

Как определить общую площадь пола и рассчитать его размер - снято на видеоСкачать

Площадь фигурыСкачать

ЧТО ТАКОЕ АНОД И КАТОД- СМОТРИ НЕ ИСПУГАЙСЯ!!!Скачать

Как высчитать квадратуру из треугольника,трапеции и т. д.Скачать

калькулятор расчета площади кровлиСкачать

Аноды и их применение в водной техникеСкачать

Как быстро посчитать площадь кровли на любом здании? (Проектирование деревянных конструкций)Скачать