Видео:Практическое занятие 5. Уравнение БЭТ. Удельная поверхностьСкачать

Измерение удельной поверхности. Метод БЭТ
Методы анализа поверхности тел с участием сорбируемых газов приобрели особое значение в связи с появлением новых материалов с уникальной структурой и свойствами.
Для измерения удельной поверхности и пористой структуры высокодисперсных твердых тел или систем с развитой пористостью, таких, как порошки, адсорбенты, катализаторы, а также для расчета размера нанесенных частиц широко используются изотермы адсорбции, – экспериментальные зависимости адсорбции a от давления р/р0 при постоянной температуре.
Существует несколько методов математического описания физической адсорбции.
Определение удельной поверхности методом БЭТ (Брунауэра-Эммета-Теллера) является наиболее распространенным методом. В нем используются следующие допущения: поверхность адсорбента однородна; взаимодействие адсорбент–адсорбат сильнее, чем адсорбат–адсорбат; взаимодействие адсорбированных молекул учитывается только в направлении, перпендикулярном поверхности, и рассматривается как конденсация. Для вычисления площади поверхности адсорбента определяется объем газа относительно мономолекулярного слоя и площадь поперечного сечения молекулы адсорбированного газа. Принято считать, что метод БЭТ можно использовать для измерения площади поверхности с точностью 5-10% в интервале значений относительного давления р/р0 0,05-0,35.
Видео:5.1. Адсорбция. Классификация адсорбцииСкачать

Глава 2. Определение удельной поверхности наноматериалов
Адсорбционным методом Ленгмюра
Учебные цели. В результате изучения материала занятия обучаемые должны:
Иметь представление
об основных терминах и определениях, принятых при описании сорбционных явлений;
Знать
основные положения теории адсорбции;
уметь:
применять процедуру расчета основных параметров изотермы адсорбции Ленгмюра и определения удельной поверхности наноматериалов;
иметь навык:
в проведении инженерных расчетов и анализе полученных результатов.
Основные положения теории адсорбции
Введение.
Основной характеристикой наноматериалов, в том числе полимерных композиционных наноразмерных материалов, определяющей отнесение их к данной группе веществ, является степень их дисперсности, то есть характерный размер структур, образующих данный материал. Поэтому экспериментальные методы измерения степени дисперсности наноматериалов, оценки размеров отдельных частиц занимают центральное место при характеристике любого наноматериала. В ряду этих методов важную роль играет измерение удельной поверхности наноматериала – величины межфазной поверхности всех образующих наноматериал структурных элементов в единице массы образца. Чем выше степень дисперсности наноматериала, тем больше величина его удельной поверхности. При разработке технологии наноматериалов часто именно их поверхность является целевой характеристикой, определяющей преимущества их использования. Одним из экспериментальных подходов к измерению удельной поверхности твердых дисперсных материалов является сорбционный метод.
Метод сорбции и капиллярной конденсации газов позволяет определять важнейшие характеристики твердофазных веществ, такие как удельная площадь поверхности, пористость (микро-, мезопористость), объем пор, распределение пор по размерам. Данные характеристики особо важны при исследовании веществ, обладающих каталитическими, фотокаталитическими, мембранными и адсорбционными свойствами.
Данные, получаемые при измерение сорбции газов, могут быть использованы при работе с наноструктурированными материалами. Метод сорбции и капиллярной конденсации удачно дополняет другие методы анализа материалов такие как дифракционные методы анализа и микроскопия и др., давая более полную информацию об образце.
Площадь поверхности может быть вычислена при помощи ряда классических моделей (BET, метод Ленгмюра и др.) при обработке данных адсорбции газа образцом. В данной работе будет рассмотрен метод Ленгмюра.
2.1.2. Основные определения.
Адсорбция — обогащение (т. е. положительная адсорбция, или просто адсорбция) или обеднение (т.е. отрицательная адсорбция) одного или более компонентов в межфазном слое. Таким образом, адсорбция представляет собой концентрирование вещества на поверхности раздела фаз (твердая — жидкая, твердая — газообразная, жидкая — газообразная).
Вещество, на поверхности которого происходит адсорбция, называется адсорбентом, а поглощаемое из объемной фазы вещество называется адсорбатом.
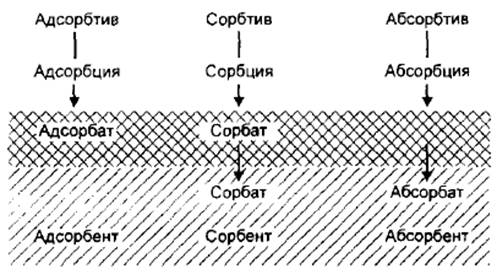
Обратный процесс перехода вещества с поверхности в объем фазы — десорбция.На рис.2.1 приведены производные термины, принятые при описании сорбционных явлений.
Сорбция — адсорбция на поверхности, абсорбция путем проникновения молекул в решетку твердого тела и капиллярная конденсация в порах. Слово адсорбция обозначает поглощение у поверхности тела в отличие от абсорбции — поглощения в объеме тела, например растворения газа в объеме жидкости.
Адсорбат (сорбат) – газообразное или жидкое вещество, которое сорбируется на границе адсорбента.
Сорбент – вещество-поглотитель.
Если хотят при этом указать характер поглощения, то употребляют термины «адсорбент» или «абсорбент». Поглощаемое вещество, находящееся в газовой среде, называют сорбтивом (соответственно, адсорбтивом или абсорбтивом), в адсорбционной фазе — сорбатом (соответственно, адсорбатом или абсорбатом).
Рис. 2.1. Термины, принятые при описании сорбционных явлений
Физическая адсорбция – адсорбция за счет короткодействующих неспецифических ван-дер-ваальсовых сил.
Химическая адсорбция (хемосорбция) – сорбция за счет специфических химических взаимодействий с образованием устойчивых поверхностных соединений.
Изотерма адсорбции (сорбции) – зависимость сорбированного количества от давления газа (пара) при постоянной температуре. Форма изотермы сорбции характеризует морфологию и физико-химические свойства поверхности сорбента и характер его взаимодействия с сорбатом.
Единицы количества адсорбированного вещества – моль/г адсорбента. При сорбции газов часто количество адсорбированного вещества выражают в см 3 газа при нормальных условиях/1 г адсорбента.
Мера дисперсности. Мерой раздробленности всякой дисперсной системы может служить либо поперечный размер частиц “а” (для сферических частиц — диаметр “d”, а для частиц, имеющих форму куба — ребро куба “l”), либо обратная ему величина Д=1/а, называемая обычно дисперсностью, либо удельная поверхность Sуд, т.е. межфазная поверхность, приходящаяся на единицу объема дисперсной фазы. Все эти величины взаимосвязаны. Чем меньше размер частиц, тем больше дисперсность или удельная поверхность, и наоборот. К коллоидным системам относятся системы, у которых значение “а” лежит в пределах 1…100 нм (10 -7 … 10 -5 см), а дисперсность — в пределах 1…100 нм-1 (10 7 …10 5 см -1 ). Верхний предел дисперсности коллоидных систем обусловлен тем, что при дальнейшем дроблении вещества в растворе уже будут находиться не агрегаты молекул, а отдельные молекулы, имеющие размер порядка 0,1 нм.
Явление сорбции.
Твердые тела могут поглощать относительно большие объемы конденсирующихся газов. Величина поглощенного объема зависит от типа материала твердого тела и природы газа. Существенную роль в адсорбционных явлениях, происходящих на твердых телах, играют два фактора: площадь поверхности твердого тела и его пористость (объем пор). Таким образом, измеряя адсорбцию газов и паров, можно получать информацию об удельной поверхности и пористой структуре твердых тел.
Термин адсорбция первоначально означал конденсацию газов на открытых поверхностях (в отличие от абсорбции, в результате которой молекулы газа проникают в массу абсорбирующего твердого тела). Адсорбция в настоящее время принята как международный термин, означающий обогащение (т.е. адсорбцию) или обеднение (т.е. десорбцию) одного или более компонентов в межфазном слое. Общий термин сорбция означает адсорбцию на поверхности, абсорбцию путем проникновения молекул в решетку твердого тела и капиллярную конденсацию в порах (рис. 2.2). Однако этот термин не получил широкого распространения, тогда как термином «адсорбция» часто называют поглощение, происходящее как по механизму капиллярной конденсации, так и собственно поверхностной адсорбции.
Рис. 2.2. Схематичное изображение процесса сорбции газа:
а) сильно увеличенная частица твердого вещества; б) образование монослоя адсорбированных молекул (насыщение
20%); в) капиллярная конденсация, образование мультислоев (насыщение
70%); г) полное заполнение всего объема пор (насыщение
На практике методы адсорбции обычно используются для определения удельной поверхности и пористой структуры лишь высокодисперсных твердых тел или систем с развитой пористостью. Обычно частицы высокодисперсного порошка – первичные частицы – под действием поверхностных сил слипаются в более или менее плотные вторичные частицы. Если контакты между соседними частицами слабые, эти ансамбли, называемые в этом случае агрегатами, могут снова разрушаться. При повышенных температурах или при прессовании под давлением первичные частицы соединяются в более прочные вторичные частицы – так называемые агломераты.
Приступая к обсуждению поверхностных свойств твердых тел с большой удельной поверхностью, полезно провести различие между внешней и внутренней поверхностями. Различие между двумя типами поверхности в известной степени произвольно, однако, считают, что выступы и трещины, высота или глубина которых меньше, чем ширина, образуют внешнюю поверхность, а трещины, поры и полости, глубина которых больше, чем их ширина, образуют внутреннюю поверхность. Несмотря на такую неопределенность проводить различие между внешней и внутренней поверхностями практически полезно; у большинства пористых тел внутренняя поверхность на несколько порядков больше, чем внешняя, и общая поверхность твердых тел является преимущественно внутренней.
В благоприятных случаях осажденный образец может иметь такую открытую структуру, что его адсорбционные и иные свойства окажутся такими же, как у непористого материала. Твердые тела такого типа используются при получении стандартных изотерм адсорбции, которые имеют фундаментальное значение при определении удельной поверхности и пористой структуры адсорбционными методами.
2.1.4. Изотермы адсорбции – десорбции.
Если твердое тело помещают в замкнутое пространство, заполненное газом или паром при определенном давлении, твердое тело начинает адсорбировать газ и масса его возрастает, а давление газа уменьшается. Спустя некоторое время давление становится постоянным и равным, скажем, Р и масса тела перестает увеличиваться. Основываясь на законах идеальных газов, если известны объемы сосуда и твердого тела, можно, исходя из снижения давления, рассчитать количество адсорбированного газа. В таком эксперименте вещество, адсорбированное твердым телом (адсорбентом), называют адсорбатом, а газообразное вещество, способное адсорбироваться, — адсорбтивом. Адсорбция вызывается силами, действующими между твердым телом и молекулами газа. Эти силы делятся на два главных типа – физические и химические, и они вызывают физическую (или Ван-дер-Ваальса) адсорбцию и хемосорбцию, соответственно.
Количество поглощенного твердым телом газа пропорционально массе m образца и зависит также от температуры, Т, давления газа Р и природы как твердого тела, так и газа. Если n – количество адсорбированного газа, выраженное в молях на грамм вещества, то
n = f(Р,T, газ, твердое тело) (2.1)
Для данного газа, адсорбированного на определенном твердом теле при какой-либо фиксированной температуре, уравнение (2.1) принимает следующий вид: n = f(Р)Т, газ, твердое тело (2.2)
Если температура ниже критической температуры газа, то применяют следующее уравнение: n = f(Р/Р0)Т, газ, твердое тело (2.3)
где Р0 – давление насыщенных паров адсорбтива.
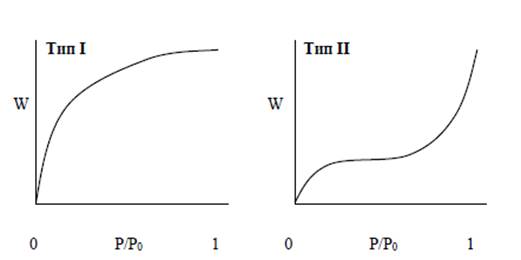
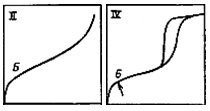
Уравнения (2.2) и (2.3) называются уравнениями изотерм адсорбции, выражающих соотношение между количеством адсорбата и давлением при постоянной температуре. Из вида изотермы адсорбции можно сделать вывод о площади поверхности, пористости адсобирующего тела и характере взаимодействия между адсорбентом и адсорбатом. Когда количество адсорбированного на поверхности вещества измеряется в широком диапазоне относительных давлений при постоянной температуре, полученные данные позволяют построить изотерму. Анализаторы сорбции газов предоставляют возможность последовательного построения изотермы по точкам на основе измеренных значений объемов азота и измеренных давлениях при равновесии. Аналогично можно получить и изотермы десорбции, измеряя количества выделенного азота при снижении относительного давления. Все изотермы адсорбции можно разделить на пять разновидностей, показанных на рис. 2.3.
Тип I или изотерма Лэнгмюра (Langmuir) выпукла относительно оси Р/Р0 и количество адсорбата приближается к пределу при возрастании Р/Р0 до 1. Такого типа изотермы присущи, в основном, микропористым образцам с относительно небольшой внешней поверхностью (например, активированный уголь или молекулярные цеолиты). Предельное количество адсорбата зависит больше от доступного объема микропор, чем от площади внутренней поверхности.
Рис. 2.3. Типы изотерм
Тип II. Такая изотерма присуща непористым или макропористым адсорбентам. Этот тип изотерм представляет свободную моно-полислойную адсорбцию. Точка начала прямолинейного среднего участка изотермы обычно используется для определения относительного давления, при котором завершается адсорбция монослоя.
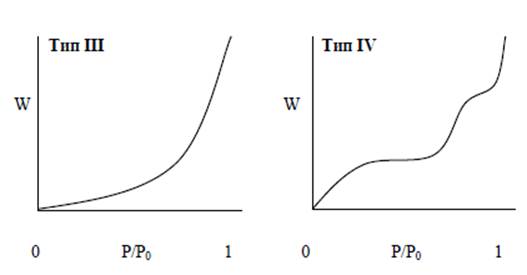
Тип III. Такая изотерма вогнута относительно оси Р/Р0 на всем своем протяжении. Это редкий тип изотермы. Хорошо известным примером является адсорбция водного пара на непористом углероде. Отсутствие точки перегиба обусловлено повышенным взаимодействием адсорбат — адсорбат по сравнению с адсорбат — адсорбент.
Тип IV. Такая изотерма ассоциируется с капиллярной конденсацией в мезопорах, что характеризуется увеличенной крутизной при повышенном относительном давлении. Начальный участок этой изотермы аналогичен изотерме типа II.
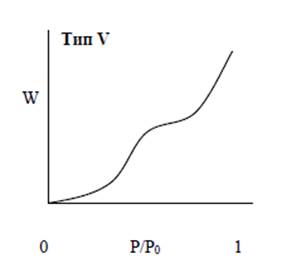
Тип V. Изотермы такого типа встречаются чрезвычайно редко. Они являются разновидностью типа III в присутствии мезопор.
Изотермы типов I, II и III как правило, обратимы. Типы IV и V, ассоциирующиеся с мезопорами, обычно показывают гистерезис между изотермами адсорбции и десорбции.
Де Бэр выделил пять типов петель гистерезиса (рис. 2.4), которые он относит к различным формам пор. Гистерезис типа А относится к порам цилиндрической формы; тип В – к щелевидным порам; тип С – к клиновидным порам с открытыми концами; тип D – также к клиновидным порам с сужением в одном или в обоих концах; тип Е – к порам типа «чернильницы», т.е. к глухим порам. Характерно, что в отсутствие микропор петли гистерезиса на всех изотермах в процессе десорбции смыкаются ранее, чем относительное давление достигнет величины 0.3. Кроме пяти классических типов существуют и такие изотермы, которые трудно отнести к какому-то одному определенному типу, и таких изотерм довольно много.
Видео:Поверхностные явления. Адсорбция.Скачать

Методы определения удельной поверхности
Самый распространенный в настоящее время, простой в исполнении и точный метод определения удельной поверхности – это волюметрический метод адсорбции газа на поверхности исследуемого материала. Удельная поверхность рассчитывается по объему газа, необходимого для формирования мономолекулярного слоя на поверхности адсорбента. Измерение удельной поверхности происходит следующим образом. Ячейка с образцом постоянно поддерживается при температуре, достаточной для превращения газа-адсорбата в жидкость. В ячейку дозированными порциями подается газ-адсорбат до достижения в ячейке термодинамического равновесия при заданном давлении. В процессе анализа получают частичную или полную изотерму адсорбции, т.е. зависимость объема адсорбата, сорбировавшегося на пробе, от величины давления в ячейке с пробой. Существует довольно большое число уравнений, описывающих изотерму адсорбции, наибольшую применимость получило уравнение БЭТ (Браунер, Эммет, Теллер).
где P – равновесное давление адсорбата, P 0 – давление его насыщенных паров, W — масса газа, адсорбированного при относительном давлении Р/Р 0 , W m – вес адсорбированного вещества, образующего монослой, С – константа ВЕТ, относящаяся к энергии адсорбции в первом монослое и, следовательно, ее значение характеризует взаимодействие адсорбент/адсорбат.
Уравнение БЭТ носит линейный характер и может быть использовано, если экспериментальная зависимость 1/W[(P 0 /P)-1] от P/P 0 также линейна. Для большинства мезопористых материалов линейный характер зависимости наблюдается на небольшом участке изотермы адсорбции, обычно в пределах от 0.05 до 0.35 по шкале относительного давления P/P 0 .
Для микропористых материалов линейный диапазон БЭТ еще больше смещен в сторону малых давлений. Вес монослоя адсорбата W m можно получить из наклона прямой на графике 1/W[(P 0 /P)-1] от P/P 0 и величины отрезка, отсекаемого прямой на оси ординат.
Помимо метода БЭТ для определения удельной поверхности пользуются методами Лэнгмюра, теориии функцилналов плотности и др.
Автоматические анализаторы удельной поверхности NOVA и NOVAtouch позволяют быстро и точно определять удельную поверхность материалов, а также общий объем и распределение пор по размерам. У этих анализаторов может быть от одной до четырех измерительных станций для одновременного анализа. Также анализаторы оснащены встроенными станциями подготовки образца (дегазации), с нагревательными муфтами до 350 0 С и вакуумированием, в том числе, и в течение анализа, что существенно экономит время оператора. В анализаторах NOVAtouch имеется четыре станции дегазации вне зависимости от количество измерительных станций. Увеличенный объем сосуда Дьюара (2л) позволяет проводить длительные измерения, что особенно важно при исследовании размеров пор образцов. По мере испарения жидкого азота из дьюара он автоматически поднимается вверх прибором для компенсации испарения и поддержания ростоянства уровня погруженности измерительной ячейки. Анализаторы NOVA и NOVAtouch решают задачу определения удельной поверхности для практически всех типовых применений.
Существуют и другие методы определения удельной поверхности материалов, но они в настоящее время уже малоупотребимы:
Метод определения удельной поверхности на основе воздухопроницаемости материала состоит в следующем. Известно, что с уменьшением размеров частиц дробленого материала сужаются просветы между ними. Поэтому воздух просасывается тем труднее, чем мельче порошок. Козени предложил уравнение ламинарного протекания жидкости или воздуха через исследуемый пористый слой материала, в котором выразил скорость протекания как функцию удельной поверхности. Это уравнение рассматривает зернистый слой как ряд одинаковых по размерам канальцев, сумма объема которых равна объему пустот между зернами, а общая их внутренняя поверхность равна сумме поверхности зерен.
Метод определения удельной поверхности материала по покрытию материала масляной пленкой разработал П. Крамер. Поверхность дробленого материала определяется путем расчета количества масла, покрывающего исследуемый материал сплошной пленкой. Высушенный очищенный материал с определенной гранулометрией помещают в мешочек и заливают машинным маслом. Через некоторое время пробу центрифугируют, в результате чего избыток масла вытекает из мешочка. После окончания центрифугирования на дне мешочка остается материал, покрытый масляной пленкой. Затем взвешивают мешочки вместе с содержимым. По разнице весов до и после центрифугирования вычисляют количество масла, оставшегося на поверхности зерен. Такой метод пригоден только для крупнодисперсных материалов.
Метод Гаркинса–Юра заключается в том, что адсорбент, предварительно насыщенный парами адсорбата, погружают в жидкий адсорбат в калориметре и по теплоте ΔQ (Дж/г), выделившейся вследствие исчезновения границы жидкость-газ, рассчитывают удельную поверхность адсорбента.
🎥 Видео
АдсорбцияСкачать

Адсорбция. Простой эксперимент дома / ХимХопСкачать

Адсорбция на твёрдой поверхностиСкачать

Адсорбция на поверхностях растворовСкачать

Вебинар "Анализ удельной поверхности и пористости методом газовой сорбции от Anton Paar "Скачать

5.3. Адсорбция на границе жидкость-газ. Поверхностно активные вещества ПАВСкачать

Поверхностные явления: адгезия, смачивание, адсорбция | Коллоидная химияСкачать

Вебинар по анализу удельной поверхности материалов для фармацевтической промышленности от Anton PaarСкачать

SAСкачать

1 1 Удельная поверхностьСкачать

АдсорбцияСкачать

5.2. Молекулярная адсорбция ПАВ на поверхности раздела раствор-воздухСкачать

Анализ удельной поверхности волюметрическим методом на анализаторе газовой сорбции серии NOVAtouchСкачать

Поверхностные явления. Адсорбция на подвижных границах раздела фаз.Скачать

Поверхностные явленияСкачать

Готовимся к тесту Адсорбция на жидкой поверхностиСкачать

Поверхностное натяжение (видео 3) | Силы межмолекулярного взаимодействия | ХимияСкачать