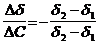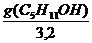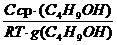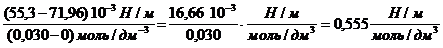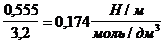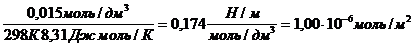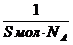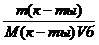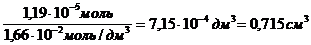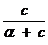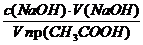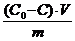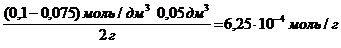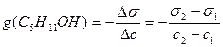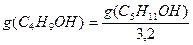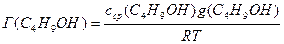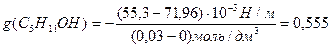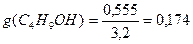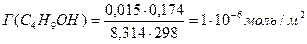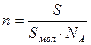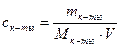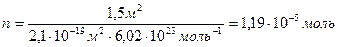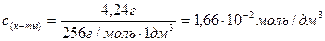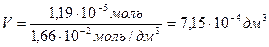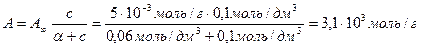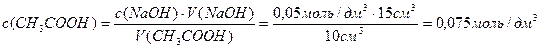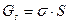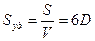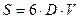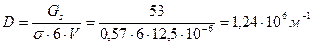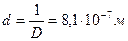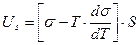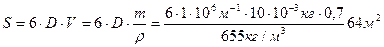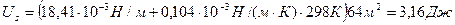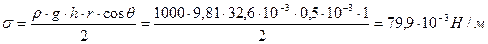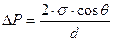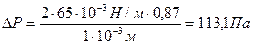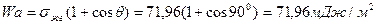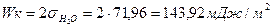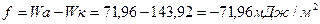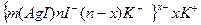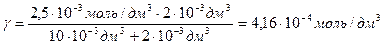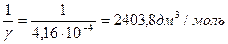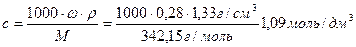Видео:Основы Сопромата. Геометрические характеристики поперечного сеченияСкачать

Примеры решения типовых задач
Пример 1
Расчет величины поверхностной активности ПАВ по изменению поверхностного натяжения; расчет величины поверхностной активности гомолога по правилу Траубе, расчет величины адсорбции ПАВ в заданном интервале концентраций.
Поверхностное натяжение водного раствора пентанола с концентрацией 0,030 моль/дм 3 равно 55,3 10 -3 Н/м при 298 К. Оцените величину адсорбции бутанола из раствора с концентрацией 0,015 моль/дм 3 при той же температуре.
Решение. Найдем поверхностную активность пентанола g(С5Н11OН) в интервале концентраций C1 = 0 (т.е. чистый растворитель) — C2= 0,030 моль/дм 3 :
g(С5Н11OН) = —
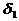
В соответствии с правилом Траубе поверхностная активность бутанола, предшествующего члена гомологического ряда предельных одноатомных спиртов, будет в тех же условиях примерно в 3,2 раза меньше:
g(С4Н9OН) =
Поскольку концентрация раствора бутанола равна 0,015 моль/дм 3 является серединой интервала, в котором рассчитывалась поверхностная активность, величина адсорбции из этого раствора рассчитывается по уравнению Гиббса:
Г(C4H9OH) =
g(С5Н11OН) =
g(С4Н9OН) =
Г(С4Н9OН) =
Ответ: величина адсорбции бутанола приблизительно равна 1 10-6 моль/м2.
Пример 2
Расчет длины и площади поперечного сечения молекулы по величине предельной адсорбции.
Площадь поперечного сечения молекулы пальмитиновой кислоты равна2,1×10 -19 м 2 . Определите величину предельной адсорбции пальмитиновой кислоты на границе бензольный раствор-воздух. Вычислите объем раствора, содержащего 4,24 г кислоты в 1 л бензола, требуемый для покрытия монослоем (после испарения бензола) 1,5 м 2 водной поверхности.
Решение.Величину предельной адсорбции данного вещества рассчитывают по уравнению:
Гmax =
Для покрытия площади S монослоем молекул с площадью поперечного сечения S мол требуется S/S мол молекул. Количество вещества, соответствующее этому числу молекул, рассчитывают по соотношению:
n= 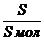
Молярная концентрация имеющего раствора пальмитиновой кислоты равна:
С(к-ты) =
Требуемый объем раствора равен: Vp = 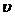
Г max = 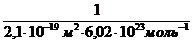
n = 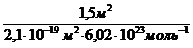
с (к-ты) = 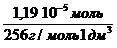
V =
Ответ: Г max = 7,9 10-6 моль/м 2 Vр = 0,715 мл
__________________________________________________________________________________
Пример 3
Расчет величины адсорбции по уравнению Ленгмюра при заданных константах.
Экспериментально установлено, что максимальная величина адсорбции ПАВ (Mr = 60) некоторым адсорбентом составляет 5,0×10 -3 моль/г; величина a равна 0,06 моль/дм 3 . Сколько граммов вещества адсорбировалось из раствора с равновесной концентрацией 0,1 моль/дм 3 двумя граммами данного адсорбента?
Решение. По уравнению Ленгмюра рассчитывают величину адсорбции ПАВ:
а = a max
Количество адсорбированного вещества на адсорбенте массой 2 г будет в 2 раза больше.
Масса адсорбированного вещества будет равна:
m (ПАВ) = n(ПАВ) М(ПАВ)
а = 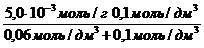
n(ПАВ) = 3,1×10-3моль/г 2 г = 6,2 10-3моль
m(ПАВ) = 6,2×10-3моль 60 г/моль = 0,37 г
Ответ: масса адсорбированного вещества равна 0,37 г.
Пример 4
Расчет величины адсорбции на твердом адсорбенте по изменению концентрации адсорбтива.
Раствор уксусной кислоты объемом60 см 3 раствора уксусной кислоты с концентрацией 0,1 моль/дм 3 взболтали с 2 г адсорбента. После достижения равновесия пробу раствора объемом 10 см 3 оттитровали раствором гидроксида натрия с = 0,05 моль/дм 3 . На титрование затрачено 15,0 см 3 титранта. Вычислите величину адсорбции уксусной кислоты.
Решение. Равновесная концентрация уксусной кислоты равна (по результатам титрования):
(СН3СООН) =
Величину адсорбции рассчитывают по:
а =
с(СН3СООН) = 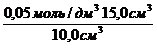
а =
Видео:26. Взаимодействие молекул. Длина свободного пробегаСкачать

Будь умным!
Работа добавлена на сайт samzan.ru: 2015-07-10
Если у вас возникли сложности с курсовой, контрольной, дипломной, рефератом, отчетом по практике, научно-исследовательской и любой другой работой — мы готовы помочь.
«>Физическая химия поверхностных явлений
;color:#000000″> «>Теоретический материал к занятию:
;color:#000000″>К поверхностным явлениям относятся процессы, происходящие на границе раздела фаз; они обусловлены особенностями состава и структуры поверх¬ностей.
;color:#000000″>Образование поверхности раздела фаз требует совер¬шения работы, следовательно, оно сопровождается увеличением свободной энергии системы. В поверхностном слое накапливается некоторый избыток энергии по¬верхностная энергия Гиббса Gs, пропорциональная пло¬щади поверхности раздела фаз S:
;color:#000000″>где σ коэффициент поверхностного на¬тяжения, т. е. работа образования единицы поверх¬ности. Коэффициент поверхностного натяжения также численно равен силе, приложенной к единице длины кон¬тура, ограничивающего поверхность, и направленной вдоль этой поверхности перпендикулярно контуру; dim σ = МТ-2, единица измерения джоуль на квадратный метр (Дж/м2) или ньютон на метр (Н/м). Следует отметить, что коэффициент поверхностного на¬тяжения часто называют поверхностным натяжением.
;color:#000000″>Самопроизвольное уменьшение свободной поверхност¬ной энергии Gs в однокомпонентных системах возможно только за счет уменьшения площади поверхности разде¬ла фаз. В многокомпонентных системах уменьшение Gs возможно также за счет уменьшения величины поверх¬ностного натяжения в результате самопроизвольного перераспределения молекул компонента между объемом фазы и поверхностью раздела. Это явление называется адсорбцией.
;color:#000000″>Границы раздела фаз газ жидкость и жидкость жидкость принято называть подвижными, а границы газ твердое тело, жидкость твердое тело, твердое тело твердое тело неподвижными. Ниже будут рас¬смотрены адсорбционные процессы в таких системах, в которых жидкость представлена водным раствором.
;color:#000000″>В зависимости от природы растворенного вещества (компонента) возможно увеличение или уменьшение его концентрации в поверхностном слое.
;color:#000000″>Положительно адсорбирующиеся вещества умень¬шают коэффициент поверхностного натяжения водной фазы, их называют поверхностно-активными веществами (ПАВ).
;color:#000000″>Молекулы ПАВ имеют характерные черты строе¬ния: они дифильны, т. е. содержат гидрофобные и гидрофильные фрагменты, и асимметричны. К ПАВ относятся одноатомные спирты, однооснов¬ные карбоновые кислоты, амины, эфиры и др.
;color:#000000″>Поверхностно-неактивные вещества (адсорбирующие¬ся отрицательно) либо не изменяют коэффициент поверхностного натяжения водной фазы, либо незначительно его увеличи¬вают. К ним относится большин¬ство неорганических веществ (кислоты, щелочи, соли).
;color:#000000″>Количественной мерой адсорб¬ции служит величина адсорбции Г (гамма);dimГ = L-2N, единица измерения моль на квадрат¬ный метр (моль/м2). Связь меж¬ду величиной адсорбции в интер¬вале концентраций и коэффици¬ентом поверхностного натяжения устанавливает уравнение Гиббса:
;color:#000000″>где Δσ приращение коэффициента поверхностного на¬тяжения, соответствующее приращению концентрации Δc;
;color:#000000″>c ;vertical-align:sub;color:#000000″>ср ;color:#000000″> среднее значение концентрации раствора в ин-тервале концентраций.
;color:#000000″>Для ПАВ при увеличении концентрации (Δс > 0) наблюдается уменьшение коэффициента поверхностного натяжения (Δσ
;color:#000000″>Величина адсорбции зависит от природы соприкасаю¬щихся фаз, природы и концентрации растворенного ве¬щества. С увеличением концентрации ПАВ величина адсорбции сначала резко возрастает, но затем дальней¬шее увеличение концентрации ПАВ вызывает незначи¬тельное увеличение этой величины и в конце концов ве¬личина адсорбции перестает зависеть от концентрации ПАВ
;color:#000000″>По теории Лэнгмюра предельной адсорбции Гмакс соответствует образование насыщенного (мономолекулярного) адсорбционного слоя, что позволяет рассчитать площадь S поперечного сечения, занимаемую одной молекулой, и ее длину l :
;color:#000000″>где N ;vertical-align:sub;color:#000000″>A ;color:#000000″> — постоянная Авогадро,
;color:#000000″> — плотность растворенного вещества,
;color:#000000″>М молярная масса.
;color:#000000″>Величина адсорбции уменьшается при увеличении температуры, что обусловлено усилением интенсивности теплового движения молекул и разупорядочиванием структуры поверхностного слоя.
;color:#000000″>Причиной адсорбции на поверхности твердых тел является нескомпенсированность силовых полей молекул, находящихся в зонах деформации регулярно устроенной поверхности. Такие зоны называют активными центрами; адсорбцию, проходящую на них, разделяют на физиче¬скую и химическую (хемосорбция). Любая поверхность, даже хорошо отшлифованная, имеет свой микрорель¬еф совокупность впадин и выступов. Физическая адсорбция обусловлена межмолекулярным взаимо¬действием (ван-дер-ваальсовым; в ряде случаев за счет образования водородных связей) и проходит, как правило, на активных центрах, находящихся во впади¬нах микрорельефа поверхности. Центры химической адсорбции находятся в основном на выступах микрорельефа; при хемосорбции устанавливаются химические связи между атомами, вхо¬дящими в состав активного центра, и атомами адсорби¬рующегося вещества.
;color:#000000″>Различия между физической адсорбцией и хемосорбцией заключаются в следующем:
;color:#000000″>1) значения стандартных энтальпий хемосорбции (порядка 80800 кДж/моль) значительно выше тако¬вых величин физической адсорбции (820 кДж/моль), значения стандартных энтальпий хемосорбции близки ΔH° химических реакций;
;color:#000000″>Классический пример адсорбции на твердом теле поглощение различных газов активированным углем. Твердое тело, на поверхности которого происходит адсорбция, называют адсорбентом, а само адсорбирую¬щееся вещество адсорбтивом. Практически процесс поглощения вещества поверхностным слоем часто допол¬няется поглощением адсорбтива всем объемом твердого тела абсорбцией, суммарный процесс (адсорб¬ция + абсорбция) называют в таком случае просто сорбцией. Сорбция обратимый процесс. Удаление сорбированного вещества называют десорбцией.
;color:#000000″>Количественно адсорбция на подвижной (Г) и непо¬движной (a) границах раздела описывается уравнением Ленгмюра:
;color:#000000″>где а ;vertical-align:sub;color:#000000″>макс ;color:#000000″> — величина предельной ад¬сорбции, она достигается при занятии всех активных центров адсорбента; dim a = М-1N, единица измере¬ния — моль/г; — постоянная величина, равная отношению кон¬стант скоростей десорбции и адсорбции, имеющая раз¬мерность концентрации.
;color:#000000″>В некоторых случаях для описания адсорбции используют эмпирическое уравнение Фрейндлиха:
;color:#000000″>a = Kc ;vertical-align:super;color:#000000″>n
;color:#000000″> где n и K — константы, определяемые экспериментально.
;color:#000000″>Величину адсорбции из раствора на твердом адсор¬бенте экспериментально определяют по изменению кон¬центрации растворенного вещества после завершения адсорбции, т. е. установления адсорбционного равнове¬сия по формуле:
;color:#000000″> (c ;vertical-align:sub;color:#000000″>o ;color:#000000″>-c)V
;color:#000000″>где co и с исходная и равновесная концентрация рас¬твора соответственно, моль/л;
;color:#000000″>V — объем раствора, из которого производилась адсорбция, л; m масса адсор¬бента, г.
;color:#000000″>Константы уравнения Ленгмюра опреде¬ляются экспериментально по графику 1/a = f(1/c).
;color:#000000″>Величина адсорбции значительно зависит от удель¬ной поверхности адсорбента. Удельная поверх¬ность адсорбента Sуд равна отношению площади его по¬верхности к объему. Она обратно пропорциональна раз¬меру частиц и зависит от их формы. При дроблении и измельчении твердых тел величина их удельной поверхности увеличивается вплоть до зна¬чений, достигающих тысячи квадратных метров на куби-ческий сантиметр твердого тела. Чем больше удельная поверхность адсорбента, тем больше имеется активных центров и, следовательно, больше величина адсорбции.
;color:#000000″>Величина адсорбции зависит от природы адсорбента и адсорбтива: чем ближе по полярности адсорбент и адсорбтив, тем полнее происходит адсорбция.
;color:#000000″>При адсорбции из растворов большое значение имеет и полярность растворителя. Наибольшей склонностью к адсорбции обладают вещества с полярностью, промежу-точной между полярностями контактирующих фаз. Из водных растворов ПАВ хорошо адсорбируются неполяр¬ными адсорбентами (в том числе активированным уг¬лем), а на полярных адсорбентах (карбонаты, алюмосиликаты, оксиды) ПАВ хорошо адсорбируются из непо¬лярных сред. В основе этих явлений лежит конкуренция между молекулами адсорбтива и растворителя за актив¬ные центры адсорбента.
;color:#000000″>В соответствии с правилом Ребиндера адсорбция идет в сторону выравнивания полярностей контактирую¬щих фаз и тем сильнее, чем больше начальная разность полярностей.
;color:#000000″>Адсорбция из растворов электролитов осложняется ярко выраженным характером электростатических взаи¬модействий, приводящих к образованию на поверхности адсорбента двойного электрического слоя (ДЭС).
;color:#000000″>Различают следующие разновидности адсорбции из растворов электролитов:
;color:#000000″>При эквивалентной адсорбции катионы и анионы адсорбируются в таких количествах, которые соответствуют нулевому суммарному заряду. Эквивалент¬ную адсорбцию формально можно рассматривать как ад¬сорбцию неэлектролита, так как при этом не возникают отрицательно или положительно заряженные поверх¬ности.
;color:#000000″>Обменная адсорбция заключается в обмене ионами между адсорбентом и раствором: адсорбенты, способные к обмену катионов, называются катионитами;
;color:#000000″>При избирательной адсорбции на по¬верхности адсорбента накапливаются либо катионы, либо анионы. Ионы противоположного заряда сохраняют при этом относительную подвижность в растворе. Таким об¬разом, в результате избирательной адсорбции возникают заряженные поверхности. В соответствии с правилом Панета Фаянса из рас¬твора преимущественно адсорбируются ионы, которые входят в состав кристаллической решетки твердой фазы, или им изоморфные. Так, например, из раствора, содер¬жащего хлорид бария и нитрат стронция, на поверхнос¬ти кристаллов сульфата бария адсорбируются ионы ба¬рия (входят в кристаллическую решетку) и ионы строн¬ция (изоморфны ионам бария); поверхность твердой фазы сульфата бария приобретает положительный заряд. Если тот же адсорбент контактирует с раствором сульфата натрия и перманганата калия, то избирательно на его поверхности адсорбируются сульфат-ионы (входят в кристаллическую решетку) и перманганат-ионы (изо¬морфны сульфат-ионам). Поверхность твердой фазы при¬обретает отрицательный заряд. Адсорбция ионов зависит от радиуса иона (она тем больше, чем больше радиус иона) и величины его заряда (многозарядные ионы адсорбируются лучше).
«>До решения задач необходимо:
«>I. Выучить определения основных понятий:
«>1) адсорбция, предельная адсорбция;
«>2) поверхностное натяжение;
«>3) коэффициент поверхностного натяжения;
«>4) поверхностно-активные и поверхностно-неактивные вещества;
«>5) поверхностная активность;
«>6) адсорбент, адсорбтив;
«>7) правило выравнивания полярностей Ребиндера.
«>II. Разобрать следующие вопросы:
«>1) подвижная и неподвижная поверхность раздела фаз;
«>2) связь между величиной адсорбции и коэффициентом поверхностного натяжения (уравнение Гиббса);
«>3) изменение величины поверхностной активности в гомологическом ряду (правило Траубе);
«>4) связь величины предельной адсорбции с площадью поперечного сечения и осевой длины молекулы;
«>5) уравнение изотермы адсорбции Ленгмюра.
«>III. Обратить внимание на:
«>1) размерность величин адсорбции на подвижной границе фаз и на твердых адсорбентах.
;text-decoration:underline»> Примеры решения типовых задач
«>Расчет величины поверхностной активности ПАВ по изменению поверхностного натяжения; расчет величины поверхностной активности гомолога по правилу Траубе, расчет величины адсорбции ПАВ в заданном интервале концентраций.
«>Поверхностное натяжение водного раствора пентанола с концентрацией 0,030 моль/дм ;vertical-align:super»>3 «> равно 55,3 10 ;vertical-align:super»>-3 «> Н/м при 298 К. Оцените величину адсорбции бутанола из раствора с концентрацией 0,015 моль/дм ;vertical-align:super»>3 «> при той же температуре.
«>Решение. «> Найдем поверхностную активность пентанола g(С5Н11OН) в интервале концентраций C1 = 0 (т.е. чистый растворитель) — C2 = 0,030 моль/дм ;vertical-align:super»>3 «> :
«>- коэффициент поверхностного натяжения воды, справочная величина (табл.11.02.).
«>В соответствии с правилом Траубе поверхностная активность бутанола, предшествующего члена гомологического ряда предельных одноатомных спиртов, будет в тех же условиях примерно в 3,2 раза меньше:
«>Поскольку концентрация раствора бутанола равна 0,015 моль/дм ;vertical-align:super»>3 «> является серединой интервала, в котором рассчитывалась поверхностная активность, величина адсорбции из этого раствора рассчитывается по уравнению Гиббса:
«>Ответ: величина адсорбции бутанола приблизительно равна 1 10-6 моль/м2.
«>Расчет длины и площади поперечного сечения молекулы по величине предельной адсорбции.
«>Площадь поперечного сечения молекулы пальмитиновой кислоты равна 2,110 ;vertical-align:super»>-19 «>м ;vertical-align:super»>2 «>. Определите величину предельной адсорбции пальмитиновой кислоты на границе бензольный раствор-воздух. Вычислите объем раствора, содержащего 4,24 г кислоты в 1 л бензола, требуемый для покрытия монослоем (после испарения бензола) 1,5 м ;vertical-align:super»>2 «> водной поверхности.
Решение. Величину предельной адсорбции данного вещества рассчитывают по уравнению:
«> Для покрытия площади S монослоем молекул с площадью поперечного сечения S мол требуется S/S мол молекул. Количество вещества, соответствующее этому числу молекул, рассчитывают по соотношению:
» xml:lang=»en-US» lang=»en-US»>n «> = «> : NA
«>Молярная концентрация имеющего раствора пальмитиновой кислоты равна:
«>Требуемый объем раствора равен: Vp = «>/с
«>Г max = «> = 7,9 10-6 моль/м2
» xml:lang=»en-US» lang=»en-US»>n «> = «> = 1,19 10-5 моль
«>с (к-ты) = «>= 1,66 10-2 моль/дм3
«>Ответ: Г max = 7,9 10-6 моль/м ;vertical-align:super»>2 «> Vр = 0,715 мл
«>Расчет величины адсорбции по уравнению Ленгмюра при заданных константах.
«>Экспериментально установлено, что максимальная величина адсорбции ПАВ (M ;vertical-align:sub»>r «> = 60) некоторым адсорбентом составляет 5,010 ;vertical-align:super»>-3 «> моль/г; величина равна 0,06 моль/дм ;vertical-align:super»>3 «>. Сколько граммов вещества адсорбировалось из раствора с равновесной концентрацией 0,1 моль/дм ;vertical-align:super»>3 «> двумя граммами данного адсорбента?
Решение. По уравнению Ленгмюра рассчитывают величину адсорбции ПАВ:
«>Количество адсорбированного вещества на адсорбенте массой 2 г будет в 2 раза больше.
«>Масса адсорбированного вещества будет равна:
«>m (ПАВ) = » xml:lang=»en-US» lang=»en-US»>n «> (ПАВ) М(ПАВ)
«>а = «> = 3,1 10-3 моль/г
«>(ПАВ) = 3,110-3 моль/г 2 г = 6,2 10-3 моль
«>m(ПАВ) = 6,210-3 моль 60 г/моль = 0,37 г
«>Ответ: масса адсорбированного вещества равна 0,37 г.
«>Расчет величины адсорбции на твердом адсорбенте по изменению концентрации адсорбтива.
«>Раствор уксусной кислоты объемом «> «>60 см ;vertical-align:super»>3 «> раствора уксусной кислоты с концентрацией 0,1 моль/дм ;vertical-align:super»>3 «> взболтали с 2 г адсорбента. После достижения равновесия пробу раствора объемом 10 см ;vertical-align:super»>3 «> оттитровали раствором гидроксида натрия с = 0,05 моль/дм ;vertical-align:super»>3 «>. На титрование затрачено 15,0 см ;vertical-align:super»>3 «> титранта. Вычислите величину адсорбции уксусной кислоты.
Решение. Равновесная концентрация уксусной кислоты равна (по результатам титрования):
«>Величину адсорбции рассчитывают по:
«>с(СН3СООН) = «>= 0,075 моль/см3
«>Ответ: а (СН3СООН) = 6,25 10-4 моль/г
;color:#000000″> ;color:#000000″>Задания для самостоятельной работы из «Сборника задач и упражнений по общей химии».
«>10.31; 10.35; 10.40; ;color:#000000»>10.46,10.52; 10.54
;color:#000000″> «>Лабораторная работа 9.3
«>Влияние различных факторов на адсорбцию из растворов
«>Цель: «> Определить влияние удельной поверхности адсорбента, природы адсорбента, адсорбтива и растворителя на адсорбцию красителей из растворов.
«>Задание: «> Выяснить влияние на величину адсорбции перечисленных выше факторов.
«>Оборудование и реактивы: «> Штатив с пробирками, воронки. Водные р-ры метиленового синего, фуксина, эозина, р-р метиленового синего в этаноле, уголь активированный, каолин, кремниевая кислота, фильтровальная бумага.
«>Сущность работы: «> Визуальное наблюдение: 1) окраски адсорбента; 2) окраски фильтратов
«>после проведения адсорбции.
«>Определениие знака заряда окрашенных ионов красителей капиллярным методом на фильтровальной бумаге.
Перед проведением основных опытов устанавливают по степени растекания пятна водного раствора красителя, к каким классам (кислотным или основным красителям) относятся объекты анализа
«>Опыт 1. «>Влияние природы адсорбента и адсорбтива на адсорбцию.
«>Опыт 2. «>Влияние природы растворителя на адсорбцию.
«>Опыт 3. «>Влияние удельной поверхности адсорбента на адсорбцию.
«> Лабораторная работа 9.5
;color:#000000″>Цель: ;color:#000000″> ;color:#000000″>Приобрести навыки разделения смеси веществ с помощью тонкослойной и бумажной хроматографии.
;color:#000000″>Задание: ;color:#000000″> Разделить смесь катионов меди (П) и железа (Ш) хроматографическим методом.
;color:#000000″>Оборудование и реактивы: ;color:#000000″> Чашка Петри, химический стакан, стеклянные палочки,
;color:#000000″>капилляры, хроматографическая бумага. Р-р гксацианоферрата (П) калия(с=0,05 моль/л), насыщенный р-р сульфата меди (П) и нитрата железа (Ш).
;color:#000000″>Сущность работы: ;color:#000000″> Для разделения смеси ионов меди(П) и железа (Ш) используется адсорбционная хроматография на бумаге.Различная скорость перемещения ионов обусловлена различием их адсорбционной способности. Разделенные хроматографические зоны обнаруживаются цветной реакцией с гексацианоферратом (П) калия.
;color:#000000″>1.Наносят разделяемую смесь катионов меди(П) и железа (Ш) на бумагу.
;color:#000000″>2. Проводят хроматографическое разделение.
;color:#000000″>3. Обнаруживают разделенные зоны.
;color:#000000″>4. Описывают полученную хроматограмму.
;color:#000000″>*В выводе указывают вид хроматографии по технике выполнения и доминирующему механизму.
;color:#000000″>Объясняют расположение окрашенных зон.

Материалы собраны группой SamZan и находятся в свободном доступе
Видео:10 Молекулярная физика (10-11 кл)Скачать

II. ОБРАЗОВАНИЕ, УСТОЙЧИВОСТЬ И ЭЛЕКТРИЧЕСКИЕ СВОЙСТВА ДИСПЕРСНЫХ СИСТЕМ
ГОУ ВПО ЧЕРЕПОВЕЦКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Факультет общих математических и естественнонаучных дисциплин
_______________________________________________________________
Кафедра химии
Поверхностные явления и дисперсные системы (Коллоидная химия) Руководство к самостоятельной работе студентов по формированию навыков решения задач
Специальности: 240301- химическая технология
280102 — охрана окружающей среды и
ЧЕРЕПОВЕЦ
Поверхностные явления и дисперсные системы(Коллоидная химия). Руководство к самостоятельной работе студентов по формированию навыков решения задач:Учеб.-метод. пособие. – Череповец: ГОУ ВПО ЧГУ, 2007. —
Рассмотрено на заседании кафедры химии, протокол № 8 от 14.05.07 г.
Одобрено редакционно-издательской комиссией Факультета общих математических и естественнонаучных дисциплин ГОУ ВПО ЧГУ, протокол № 8 от 15.05.07 г.
С о с т а в и т е л и: Г.А. Котенко, канд. хим. наук, доцент;
Р е ц е н з е н т ы: Е.А.Шестакова, канд. техн. наук, доцент
Г.В. Козлова, канд. хим. наук (ГОУ ВПО ЧГУ)
Н а у ч н ы й р е д а к т о р : В.А.Котенко, канд. техн. наук, доцент
У Котенко Г.А., Ульянова О.В., 2007
У ГОУ ВПО Череповецкий государственный университет, 2007
В В Е Д Е Н И Е
Учебно-методическое пособие содержит примеры решения задач для формирования навыков количественных расчетов по трем разделам курсов «Поверхностные явления и дисперсные системы» и «Коллоидная химия»:
1. «Термодинамика и строение поверхностного слоя. Адсорбционные равновесия»;
2. «Образование, устойчивость и электрические свойства дисперсных систем»;
3. «Молекулярно-кинетические и структурно-механические свойства дисперсных систем».
Пособие составлено в соответствии с Государственным образовательным стандартом по дисциплине «Поверхностные явления и дисперсные системы» для химико-технологических специальностей высших учебных заведений.
I. ТЕРМОДИНАМИКА И СТРОЕНИЕ ПОВЕРХНОСТНОГО СЛОЯ.
АДСОРБЦИОННЫЕ РАВНОВЕСИЯ
Пример 1
Поверхностное натяжение водного раствора пентанола с концентрацией 0,030 моль/дм 3 равно 55,3 . 10 -3 Н/м при 298 К. Оцените величину адсорбции бутанола из раствора с концентрацией 0,015 моль/дм 3 при той же температуре.
Решение. Найдем поверхностную активность пентанола g (С5Н11ОН) в интервале концентраций с1=0 (т.е. чистый растворитель); с2=0,03 моль/дм 3 :
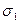
В соответствии с правилом Траубе поверхностная активность бутанола, предшествующего члена гомологического ряда предельных одноатомных спиртов, будет в тех же условиях примерно в 3,2 раза меньше:
Поскольку концентрация раствора бутанола, равная 0,015 моль/дм 3 , является серединой интервала, в котором рассчитывалась поверхностная активность, величина адсорбции из этого раствора рассчитывается по уравнению Гиббса:
Пример 2
Площадь поперечного сечения молекулы пальмитиновой кислоты равна 2,1 . 10 -19 м2 . Определите величину предельной адсорбции пальмитиновой кислоты на границе бензольный раствор – воздух. Вычислите объем раствора, содержащего 4,24 г кислоты в 1 дм 3 бензола, требуемый для покрытия монослоем (после испарения бензола) 1,5 м 2 водной поверхности.
Решение. Величину предельной адсорбции данного вещества рассчитывают по уравнению: 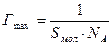
где Sмол— площадь поперечного сечения молекулы; NА— постоянная Авогадро.
Для покрытия площади S монослоем молекул с площадью поперечного сечения Sмол требуется S/Sмол молекул. Количество вещества, соответствующее этому числу молекул, рассчитывают по соотношению:
Молярная концентрация имеющегося раствора пальмитиновой кислоты равна:
Требуемый объем раствора равен: V=n/c
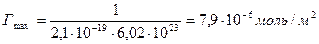
Пример 3
Экспериментально установлено, что максимальная величина адсорбции ПАВ (Мr=60) некоторым адсорбентом составляет 5 . 10 -3 моль/г; α=0,06 моль/дм 3 . Сколько граммов вещества адсорбировалось из раствора с равновесной концентрацией 0,1моль/дм 3 двумя граммами данного адсорбента?
Решение. По уравнению Ленгмюра рассчитывают величину адсорбции ПАВ:
Количество адсорбированного вещества на адсорбенте массой 2 г будет в два раза больше:
n(ПАВ) = 3,1 . 10 -3 моль/г . 2г = 6,2 . 10 -3 моль
Масса адсорбированного вещества будет равна:
m(ПАВ)= n(ПАВ) . Mr(ПАВ) = 6,2 . 10 -3 моль . 60г/моль = 0,37 г
Пример 4
Раствор уксусной кислоты объемом 60 см 3 с концентрацией 0,1 моль/дм 3 взболтали с 2 г адсорбента. После достижения равновесия пробу раствора объемом 10 см 3 оттитровали раствором гидроксида натрия (с(NaOH) = 0,05 моль/дм 3 ). На титрование затрачено 15 см 3 титранта. Вычислите величину адсорбции уксусной кислоты.
Решение. Равновесная концентрация уксусной кислоты равна (по результатам титрования):
Вычислим величину адсорбции:
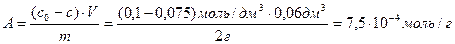
Пример 5
При конденсации тумана, состоящего из капель кадмия, образовалось 12 . 10 -6 м3 жидкого кадмия. Поверхностное натяжение при температуре конденсации равно 0,570 Н/м. Свободная поверхностная энергия всех капель составляет 53 Дж. Вычислить дисперсность и диаметр капель жидкого кадмия.
Решение. Энергия Гиббса поверхности определяется по уравнению:
Связь между удельной поверхностью Sуд, поверхностью S, объемом V и дисперсностью D выражается соотношением:
Поверхность капель тумана составляет:
Дисперсность капель кадмия равна:
диаметр капель кадмия равен:
Пример 6
Рассчитайте полную поверхностную энергию 10 г эмульсии гексана в воде с концентрацией 70% массовых и дисперсностью D = 1 мкм -1 при температуре 298К. Плотность гексана при этой температуре 0,655г/см 3 , поверхностное натяжение 18,41 . 10 -3 Н/м, температурный коэффициент поверхностного натяжения гексана 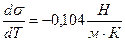
Решение. Полная поверхностная энергия рассчитывается по уравнению Гиббса-Гельмгольца:
Поверхность капель бензола 70%-ной эмульсии массой 10г, составляет:
Пример 7
Определите поверхностное натяжение жидкости, если в капилляре диаметром d = 1 . 10 -3 м она поднимается на высоту h = 32,6 . 10 -3 м. плотность жидкости равна 1000 кг/м 3 . Краевой угол смачивания равен 0 0 .
Решение. При использовании метода поднятия жидкости в капилляре для расчета применяют уравнение Жорена:
Пример 8
Две вертикальные пластинки частично погружены в жидкость на расстоянии d = 1мм друг от друга. Угол смачивания пластинок жидкостью составляет 30 0 . Поверхностное натяжение жидкости равно 65 . 10 -3 Н/м, разность плотностей жидкости и воздуха равно 1г/см 3 . Рассчитайте избыточное давление в жидкости и силу взаимного притяжения пластинок, если их размеры составляют 5×5 см.
Решение. Капиллярное (избыточное) давление в жидкости между параллельными пластинками рассчитывают по формуле:
при смачивании поверхности пластинок избыточное давление уменьшает внутреннее давление в жидкости, что приводит к ее поднятию по сравнению с уровнем жидкости в сосуде и появлению силы, прижимающей пластины:
F=ΔР . S= 113,1 . 0,5 . 0,5=0,28 Н
Такую силу нужно приложить к каждой пластинке перпендикулярно ее поверхности, чтобы оторвать пластинки друг от друга.
Пример 9
Рассчитайте работу адгезии в системе вода-графит, зная, что краевой угол равен 90 0 , а поверхностное натяжение воды составляет 71,96 мДж/м 2 . Определите коэффициент растекания воды на графите.
Решение: Выражение для работы адгезии через краевой угол дается уравнением Дюпре-Юнга :
Работа когезии:
Коэффициент растекания рассчитывается по соотношению:
II. ОБРАЗОВАНИЕ, УСТОЙЧИВОСТЬ И ЭЛЕКТРИЧЕСКИЕ СВОЙСТВА ДИСПЕРСНЫХ СИСТЕМ
Пример 1.
Золь иодида серебра получен смешиванием раствора нитрата серебра объемом 20 см 3 с с(AgNO3)=5 . 10 -3 моль/дм 3 и раствора иодида калия объемом 30 см 3 с с(KI) = 6 . 10 -3 моль/дм 3 . Назовите метод получения золя. Определите знак заряда коллоидных частиц.
Решение. Золь получен химическим конденсационным методом в результате реакции обмена: AgNO3 + KI=AgI 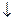
n(AgNO3) = 5 . 10 -3 моль/дм 3. 2 . 10 -2 дм 3 = 1 . 10 -4 моль;
n(KI) = 6 . 10 -3 моль/дм 3. 3 . 10 -2 дм 3 =1,8 . 10 -4 моль;
После образования золя в избытке иодида калия в растворе останутся ионы К + , NO3 — , I — . По правилу Панета-Фаянса на агрегатах AgI избирательно адсорбируются потенциалопределяющие ионы I — , обуславливающие отрицательный знак заряда коллоидных частиц.
Пример 2.
Пороги коагуляции для некоторого гидрозоля равны 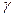
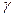
Решение. Коагулирующая способность сульфата натрия по отношению к золю выше коагулирующей способности хлорида кальция. По правилу Шульце-Гарди коагулирующая способность электролита тем больше, чем больше заряд коагулирующего иона. У Na2SO4 заряд аниона больше, чем у CaCl2. Значит, коагулирующими ионами являются анионы. Следовательно, частицы золя заряжены положительно.
Пример 3
Золь иодида серебра получен по реакции: KI + AgNO3 = AgI + KNO3
При некотором избытке KI. Его коагулируют растворами сульфата натрия и ацетата кальция. У какого электролита коагулирующая способность больше.
Решение. Так как стабилизатором золя является иодид калия, то мицелла имеет строение:
Гранула заряжена отрицательно. Следовательно, коагулирующими ионами являются катионы электролитов. Так как заряд иона Са 2+ больше заряда иона Na + , то коагулирующая способность ацетата кальция больше, чем сульфата натрия.
Пример 4.
Коагуляция гидрозоля железа (ІІІ) объемом 10 см 3 наступила при добавлении к нему раствора сульфата натрия объемом 2 см 3 с С (Na2SO4) = 0,0025 моль/дм 3 . Вычислите порог коагуляции и коагулирующую способность электролита.
Решение. Для расчета порога коагуляции используют формулу: 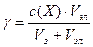
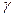
Vэл— минимальный объем раствора электролита, вызывающего коагуляцию золя; Vз— объем золя.
величину коагулирующей способности вычисляют по формуле
с =
Пример 5
Порог коагуляции золя серебра ионами алюминия равен 0,186 ммоль/дм 3 . Какой объем 28%-ного раствора сульфата алюминия (ρ=1,33 г/см 3 ) требуется для коагуляции золя объемом 2 дм 3 .
Решение. Рассчитаем молярную концентрацию 28%-ного раствора сульфата алюминия, подставив известные по условию задачи величины
Поскольку с(Al 3+ )=2c(Al2(SO4)3), концентрация иона-коагулятора будет равна 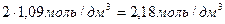
💡 Видео
Определение вязкости. Формула ПуазеляСкачать
6. Определение характеристик сечения ( практический курс по сопромату )Скачать

Лекция №1 "Основные понятия молекулярной физики"Скачать

СЕЧЕНИЯ. СТРАШНЫЙ УРОК | Математика | TutorOnlineСкачать

Как определить сечение провода.Скачать

Семинар №12 "Столкновения. Процессы переноса" (Попов П.В.)Скачать

Закон БернуллиСкачать

КАК ТЕЧЁТ ТОК В СХЕМЕ | Читаем Электрические Схемы 1 частьСкачать

Селиверстов А. В. - Молекулярная физика - Семинар 14Скачать
ЕГЭ2021.Молекулярно-кинетическая теория. Газовые законы. Насколько сложная эта темы в ЕГЭ по физике?Скачать

Пример. Геометрические характеристики плоских сечений. Часть 1Скачать

Задачи ЕГЭ и олимпиад по молекулярной физике и термодинамикеСкачать

Математика это не ИсламСкачать

Селиверстов А. В. - Молекулярная физика - Семинар 13Скачать

Лекция №12 по курсу "Термодинамика и молекулярная физика" (Катанин А.А.)Скачать

Лекция №13 по курсу "Термодинамика и молекулярная физика" (Катанин А.А.)Скачать

Селиверстов А. В. - Молекулярная физика - Семинар 17Скачать