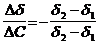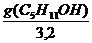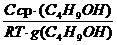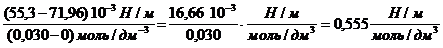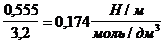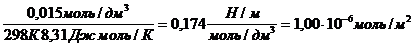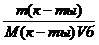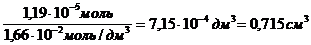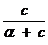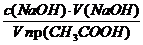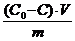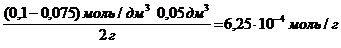Видео:Орбитальная модель молекулы водыСкачать

Примеры решения типовых задач
Пример 1
Расчет величины поверхностной активности ПАВ по изменению поверхностного натяжения; расчет величины поверхностной активности гомолога по правилу Траубе, расчет величины адсорбции ПАВ в заданном интервале концентраций.
Поверхностное натяжение водного раствора пентанола с концентрацией 0,030 моль/дм 3 равно 55,3 10 -3 Н/м при 298 К. Оцените величину адсорбции бутанола из раствора с концентрацией 0,015 моль/дм 3 при той же температуре.
Решение. Найдем поверхностную активность пентанола g(С5Н11OН) в интервале концентраций C1 = 0 (т.е. чистый растворитель) — C2= 0,030 моль/дм 3 :
g(С5Н11OН) = —
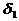
В соответствии с правилом Траубе поверхностная активность бутанола, предшествующего члена гомологического ряда предельных одноатомных спиртов, будет в тех же условиях примерно в 3,2 раза меньше:
g(С4Н9OН) =
Поскольку концентрация раствора бутанола равна 0,015 моль/дм 3 является серединой интервала, в котором рассчитывалась поверхностная активность, величина адсорбции из этого раствора рассчитывается по уравнению Гиббса:
Г(C4H9OH) =
g(С5Н11OН) =
g(С4Н9OН) =
Г(С4Н9OН) =
Ответ: величина адсорбции бутанола приблизительно равна 1 10-6 моль/м2.
Пример 2
Расчет длины и площади поперечного сечения молекулы по величине предельной адсорбции.
Площадь поперечного сечения молекулы пальмитиновой кислоты равна2,1×10 -19 м 2 . Определите величину предельной адсорбции пальмитиновой кислоты на границе бензольный раствор-воздух. Вычислите объем раствора, содержащего 4,24 г кислоты в 1 л бензола, требуемый для покрытия монослоем (после испарения бензола) 1,5 м 2 водной поверхности.
Решение.Величину предельной адсорбции данного вещества рассчитывают по уравнению:
Гmax =
Для покрытия площади S монослоем молекул с площадью поперечного сечения S мол требуется S/S мол молекул. Количество вещества, соответствующее этому числу молекул, рассчитывают по соотношению:
n= 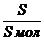
Молярная концентрация имеющего раствора пальмитиновой кислоты равна:
С(к-ты) =
Требуемый объем раствора равен: Vp = 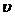
Г max = 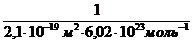
n = 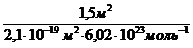
с (к-ты) = 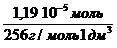
V =
Ответ: Г max = 7,9 10-6 моль/м 2 Vр = 0,715 мл
__________________________________________________________________________________
Пример 3
Расчет величины адсорбции по уравнению Ленгмюра при заданных константах.
Экспериментально установлено, что максимальная величина адсорбции ПАВ (Mr = 60) некоторым адсорбентом составляет 5,0×10 -3 моль/г; величина a равна 0,06 моль/дм 3 . Сколько граммов вещества адсорбировалось из раствора с равновесной концентрацией 0,1 моль/дм 3 двумя граммами данного адсорбента?
Решение. По уравнению Ленгмюра рассчитывают величину адсорбции ПАВ:
а = a max
Количество адсорбированного вещества на адсорбенте массой 2 г будет в 2 раза больше.
Масса адсорбированного вещества будет равна:
m (ПАВ) = n(ПАВ) М(ПАВ)
а = 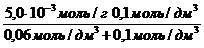
n(ПАВ) = 3,1×10-3моль/г 2 г = 6,2 10-3моль
m(ПАВ) = 6,2×10-3моль 60 г/моль = 0,37 г
Ответ: масса адсорбированного вещества равна 0,37 г.
Пример 4
Расчет величины адсорбции на твердом адсорбенте по изменению концентрации адсорбтива.
Раствор уксусной кислоты объемом60 см 3 раствора уксусной кислоты с концентрацией 0,1 моль/дм 3 взболтали с 2 г адсорбента. После достижения равновесия пробу раствора объемом 10 см 3 оттитровали раствором гидроксида натрия с = 0,05 моль/дм 3 . На титрование затрачено 15,0 см 3 титранта. Вычислите величину адсорбции уксусной кислоты.
Решение. Равновесная концентрация уксусной кислоты равна (по результатам титрования):
(СН3СООН) =
Величину адсорбции рассчитывают по:
а =
с(СН3СООН) = 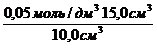
а =
Видео:Основы Сопромата. Геометрические характеристики поперечного сеченияСкачать

1.6. Строение и свойства адсорбционных слоев на границе раздела «водный раствор-воздух»
В 1916–1917 гг. американские ученые Ленгмюр и Гаркинс выдвинули предположение, что молекулы ПАВ имеют дифильное строение, т.е. состоят из двух частей — полярной и неполярной. В дальнейшем это предположение полностью подтвердилось. Эти ученые предложили обозначить молекулу ПАВ, например R-CООH, как приведено на рис. 1.17, где а – полярная часть молекулы, обеспечивающая ее склонность к гидратации, ассоциации и т.д., например группы -ОН, -NH2, -СООН, кислородсодержащие эфирные группы -ОС2Н4-, группы, содержащие гетероатом (кислород, серу, фосфор , азот и т.д.); b – неполярная часть молекулы, обладающая слабым силовым полем, например углеводородная цепь, содержащая алифатические или ароматические группы, или фторуглеродная цепь.

На рис. 1.18 приведена компьютерная модель молекулы ПАВ, представляющая собой наиболее вероятную конформацию С12H25COOH, рассчитанную с учетом длин валентных связей, величин валентных углов и внутримолекулярных взаимодействий. Сравнивая рис. 1.17 и 1.18 можно заключить о полной правомочности использования модели молекул ПАВ Ленгмюра-Гаркинса.
Полярные части молекул ПАВ обладают мощным силовым полем и способны взаимодействовать с молекулами воды, часто с образованием водородных связей, поэтому их называют гидрофильными. Углеводородная цепь (неполярная часть) выталкивается из воды, так как она обладает сродством к неполярной фазе и поэтому называется гидрофобной или олеофильной.
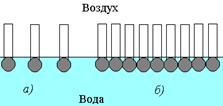
В процессе адсорбции происходит не только накопление вещества в поверхностном слое, но и ориентация молекул — полярная часть направлена в полярную среду, а неполярная — в неполярную. Схема строения адсорбционного слоя приведена на рис. 1.19.
Рис. 1.19. Схема строения адсорбционного слоя молекул ПАВ на поверхности воды:а- ненасыщенный, б- насыщенный адсорбционный слой.
Ленгмюр выдвинул и математически обосновал идею об особом строении адсорбционных слоев. Он рассматривал ненасыщенный слой как двухмерный газ. По мере того как концентрация ПАВ увеличивается происходит процесс, аналогичный конденсации двухмерного газа — молекулы образуют двухмерную пленку, которую Ленгмюр рассматривал как двухмерную жидкость. Если концентрация ПАВ в растворе неограниченно возрастает, то наступает момент предельного насыщения адсорбционного слоя, который приобретает вид частокола, так как предполагается, что слой имеет толщину, соответствующую длине адсорбированной молекулы. При этом адсорбция достигает предела. Эта теория была названа теорией мономолекулярного слоя, или монослоя.
Ленгмюр предполагал, что если при малой концентрации растворенного вещества имеются молекулы, удаленные на большое расстояние друг от друга, то они должны оказывать давление, как и обычные молекулы газа. Они будут стремиться рассеяться по поверхности, удаляясь на еще большие расстояния. В результате теплового движения они обусловят поверхностное давление Ps, действующее противоположно поверхностному натяжению:
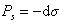
При помощи специально сконструированных поверхностных весов Ленгмюр доказал, что молекулы адсорбционного слоя действительно ведут себя как двухмерный газ.
При очень малой равновесной концентрации ПАВ в растворе, т.е. при 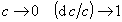

Учитывая, что 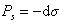
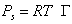
Выражая площадь, занимаемую одним молем адсорбированного вещества (двухмерный газ), через 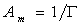
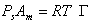
Легко увидеть, что это уравнение подобно уравнению состояния идеальных газов, т.е. уравнению Клапейрона — Менделеева.
Полученное Ленгмюром уравнение (1.1.118) представляет собой уравнение состояния двухмерного газа. Он доказал, что это уравнение справедливо в качестве предельного идеального уравнения состояния поверхностного слоя с адсорбированными молекулами.
Использование рентгеноструктурного и электронографических методов анализа показало, что тонкий слой адсорбционного вещества дает характерную структурную картину жидкого кристалла. Особенно удобен электронографический метод, позволяющий определить площадь, занимаемую одной молекулой ПАВ в адсорбционном слое при насыщении. В то же время эту площадь можно определить на основании данных об адсорбции, так как если насыщение адсорбционного слоя полное, то площадь, занимаемая одной молекулой, становится строго определенной и характерной для данного вида молекул:
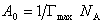
где NA – число Авагадро.
Измерив адсорбцию, можно определить не только площадь поперечного сечения молекул (площадь, занимаемую в насыщенном адсорбционном слое), но и их осевую длину.
Моделируя молекулу ПАВ в виде цилиндра и обозначая осевую длину молекулы h, а площадь поперечного сечения A0, получаем для объема одной молекулы ПАВ V1= A0h. Если взять один моль ПАВ
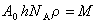
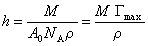
где r – плотность адсорбированного вещества, обычно принимаемая равной плотности ПАВ в конденсированном состоянии.
Установлено, что в гомологическом ряду ПАВ с увеличением длины углеводородного радикала на одну группу -СН2— происходит рост осевой длины молекулы на (1,3¸1,5)10 — 10 м. Следовательно, по измеренной адсорбции можно рассчитать даже длину валентной связи между атомами или размеры каких-либо групп атомов. Наименьшую площадь в насыщенном адсорбционном слое занимает молекула спирта, эта площадь составляет 20,2·10 — 20 м 2 .
Многочисленные исследования подтвердили первоначально сделанное Ленгмюром предположение о мономолекулярности адсорбционного слоя на поверхности водного раствора ПАВ.
Видео:молекулы воды для МилыСкачать

Примеры решения типовых задач. Пример 1. Определите энергию Гиббса Gs поверхности капель водяного тумана (массой капель m = 4 г) при 293К
Пример 1. Определите энергию Гиббса Gs поверхности капель водяного тумана (массой капель m = 4 г) при 293К, если поверхностное натяжение воды σ = 72,7 мДж/м 2 , плотность воды ρ = 0,998 г/см 3 , радиус капли тумана r =10 — 8 м.
Поверхностная энергия Гиббса определяется по уравнению
Gs = s · 
Cвязь между удельной поверхностью 



Отсюда поверхность капель тумана составляет






и энергия Гиббса равна
GS = σ· 

GS = (3 · 0,0727Дж/м 2 · 4·10 -3 кг) / (998 кг/м 3 ·10 -8 ) = 87,41 Дж.
Пример 2. Шарик из золота радиусом R= 0,5 см равномерно диспергируют до образования сферических частиц радиусом
r =1·10 -6 см. Какова суммарная площадь поверхности золота в полученной дисперсии? Во сколько раз увеличивается площадь поверхности?
Объем исходного шарика из золота равен

а площадь его поверхности


Объем сферической частицы золота v равен:

Общий объем золота не изменился, поэтому легко сосчитать число образовавшихся сферических частиц:

суммарная поверхность которых

Следовательно, площадь поверхности увеличивается в

Пример 3. Какова площадь поперечного сечения молекулы стеариновой кислоты С17Н35СООН, если 0,0001 г ее образует на поверхности воды мономолекулярный слой площадью 470 см 2 .
Определим молекулярную массу стеариновой кислоты М = 17 · 12 + 35 + 12 + 32 + 1 = 284 (г/моль). Следовательно, 1 моль стеариновой кислоты равен 284 г, а моль любого вещества составляет число Авогадро молекул, т.е. 6,02 · 10 23 . Отсюда можно узнать, какое число молекул содержит 0,0001 г стеариновой кислоты:
284 г — 6,02 ·10 23 молекул
0,0001г — x молекул
х = 6,02 ·10 23 · 10 -4 /284 = 2,12 · 10 17
В 0,0001 г стеариновой кислоты содержится 2,12 · 10 17 молекул С17Н35СООН. Площадь, занимаемая этими молекулами, равна 470 см 2 . Следовательно, площадь, занимаемая одной молекулой, будет составлять:
470 см 2 /2,12 · 10 17 = 222 · 10 — 17 см 2 = 22,2 · 10 — 20 м 2 = 22,2
(1 
Пример 4. Вычислите удельную площадь поверхности катализатора, 1 г которого адсорбирует 95 мл N2 (при нормальных условиях) до образования мономолекулярного слоя. Площадь поперечного сечения адсорбированной молекулы N2 равна 16,2 
Удельная площадь поверхности равна




📸 Видео
Урок 122 (осн). Сколько молекул воды ежесекундно испаряется с 1 кв.см ее поверхности?Скачать

СЕЧЕНИЯ. СТРАШНЫЙ УРОК | Математика | TutorOnlineСкачать

Строение молекулы водыСкачать

№ 196. Неорганическая химия. Тема 23. Вода. Часть 2. Строение молекулы водыСкачать

Дипольный момент (видео 26) | Химические связи и структура молекул | ХимияСкачать

Водородные связи между молекулами воды (видео 1) | Биологическая роль воды | БиологияСкачать

Физика 7 класс (Урок№4 - Строение вещества. Молекулы и атомы. Измерение размеров малых тел.)Скачать

Математика это не ИсламСкачать

Молекула воды (без слов)Скачать
Раскрыта структура и строение молекулы воды.Скачать

Урок 13 (осн). Взаимодействие молекул. Смачивание и несмачиваниеСкачать

ОГЭ Физика 2024 Камзеева (ФИПИ) 30 типовых вариантов, вариант 9, подробный разбор всех заданийСкачать

Какова масса молекулы воды? Количество вещества, Задача 2, Физика, ЕГЭ, ОГЭСкачать

№ 501-600 - Физика 10-11 класс РымкевичСкачать

Урок 141. Количество вещества. Молярная масса. Оценка размеров молекулСкачать

Определение центра тяжести сложных сечений. Фигуры из ГОСТ.Скачать

Взаимное притяжение и отталкивание молекул | Физика 7 класс #6 | ИнфоурокСкачать