Видео:Фармакокинетика: всасывание, распределение, биодоступность лекарственных препаратовСкачать

Площадь под кривой концентрация время auc
(А) Лекарственные средства попадают в организм и выводятся из него разными путями. Таким образом, организм представляет собой открытую систему, в которой фактическая концентрация препарата отражает взаимодействие между его поступлением (приемом) и эвакуацией (элиминацией).
Скорость всасывания препарата в желудке и кишечнике зависит от множества факторов: скорости растворения вещества (в случае приема твердой лекарственной формы) и транзита по ЖКТ, проницаемости слизистой для препарата, его градиента концентрации на границе слизистой и крови,кровоснабжения слизистой оболочки.
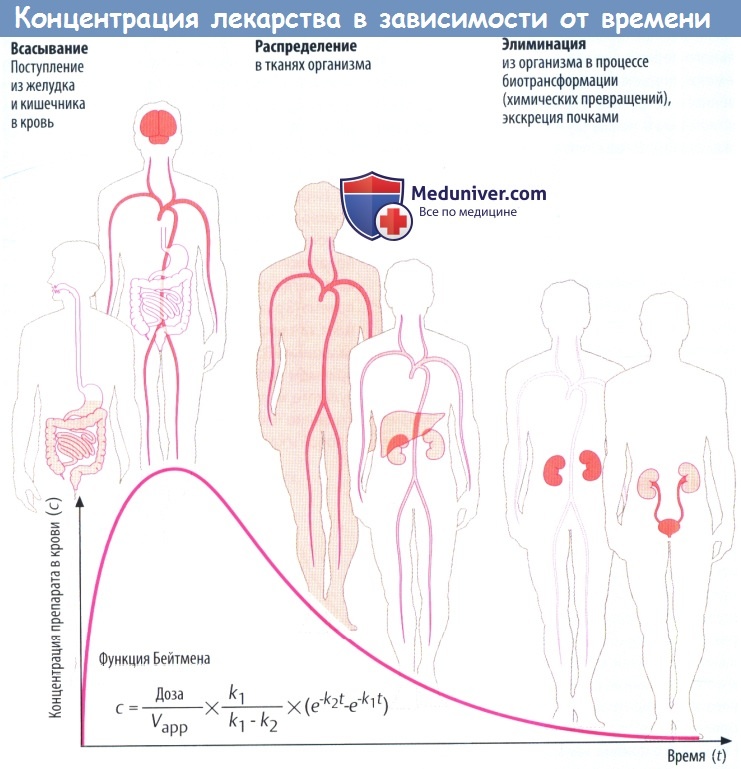
Всасывание из кишечника приводит к повышению концентрации лекарственного вещества в крови. Препарат разносится с кровью к различным органам (распределение), которые поглощают его в количестве, соответствующем его химическим свойствам и скорости кровотока через орган.
Например, органы с хорошим кровоснабжением, такие как головной мозг, получают большее количество препарата, чем органы с низким кровоснабжением. В результате поглощения тканями происходит снижение концентрации лекарственного вещества в крови. По мере снижения градиента на границе слизистой оболочки и крови всасывание в кишечнике замедляется. Пик концентрации в крови достигается тогда, когда количество вещества, покидающего кровь за единицу времени, равно количеству всосавшегося.
Поступление вещества в ткани печени и почек представляет собой перемещение в органы выведения. Концентрация препарата в крови в различные периоды времени представляет собой совокупность процессов абсорбции, распределения и элиминации, которые пересекаются во времени.
Если распределение происходит значительно быстрее, чем элиминация, снижение концентрации в крови вначале происходит быстро, а затем замедляется. Фаза быстрого снижения обозначается как α-фаза (фаза распределения), медленного — как β-фаза (фаза элиминации). Если препарат распределяется быстрее, чем абсорбируется, концентрацию препарата в крови можно описать математически упрощенной функцией Бейтмена (k1 и k2 — константы скорости для абсорбции и элиминации соответственно).
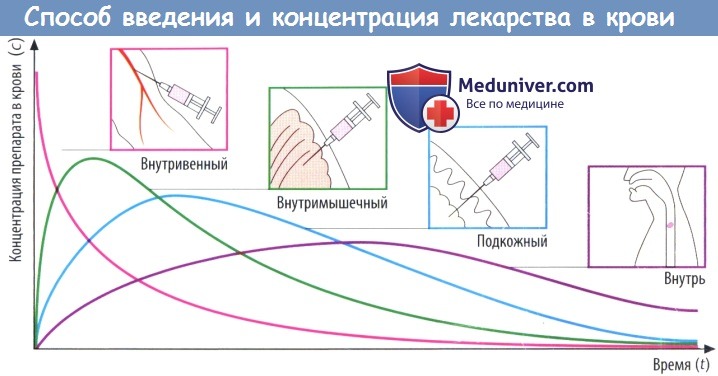
(В) Скорость абсорбции зависит от способа введения препарата. Чем выше скорость абсорбции, тем короче будет время (tmax), которое требуется для достижения пика концентрации в плазме (cmax), тем выше будет cmax и тем раньше уровень препарата в крови снова начнет снижаться.
Площадь под кривой, описывающей зависимость концентрации препарата в крови от времени (AUC), не зависит от пути введения препарата при условии, что доза и биодоступность остаются теми же (закон соответственных состояний). Таким образом, AUC можно использовать для вычисления биодоступности (F) препарата.
Значение AUC, измеренное после приема внутрь и в/в введения определенной дозы конкретного лекарственного вещества, соответствует проценту вещества, попавшего в системный кровоток после приема внутрь: F = AUCприем внутрь/AUCв/в введение.
Определение концентрации препарата в крови позволяет сравнить различные патентованные лекарственные средства, содержащие одно и то же действующее вещество в одинаковой дозе. Идентичные кривые зависимости концентрации в крови от времени для препаратов различных производителей (при условии стандартных лекарственных форм) означают биоэквивалентность стандартного вещества и нового исследуемого препарата.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Видео:2.2. Ход фармакокинетическо-статистического анализаСкачать
Площадь под фармакокинетической кривой
В фармакокинетике понятие «площадь под кривой» имеет особое значение. Оно представляет собой область под линией, нанесенной на график концентрации медицинского препарата в плазме крови в зависимости от времени. Обычно площадь рассчитывается для периода с момента введения препарата до снижения концентрации в плазме до незначительного уровня. Площадь под кривой демонстрирует общее воздействие активного вещества на организм и позволяет оценивать и сравнивать биодоступность различных медицинских препаратов. Время, когда в крови наблюдается самая высокая концентрация активного
вещества, обозначено как Тмакс, а максимальная концентрация активного вещества обозначена Cмакс.
При изучении биоэквивалентности лекарственных препаратов наиболее важными являются следующие фармакокинетические параметры (рис.1)
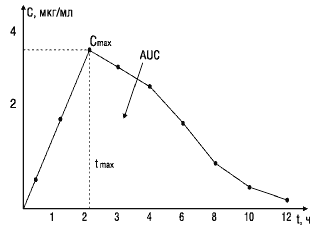
Cmax — максимум, или пик концентрации лекарственного вещества в крови;
tmax — время достижения максимальной концентрации вещества в плазме крови;
AUC— площадь под фармакокинетической кривой — кривой «концентрация—время» (изменение концентрации активного вещества в плазме или сыворотке крови во времени).
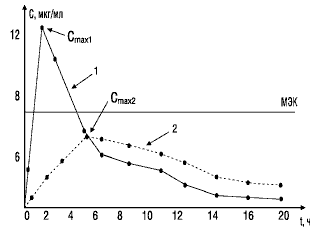
Значение показателя максимальной концентрации вещества можно объяснить с помощью следующего примера. На рис. 2 представлены фармакокинетические кривые двух лекарственных препаратов. Кривая 1 характеризует концентрацию в крови стандартного препарата, кривая 2 — тестируемого. Горизонтальной линией отмечена минимальная эффективная концентрация, при которой данное вещество оказывает терапевтическое действие. Как видно, Сmax тестируемого препарата (кривая 2) не достигает уровня минимальной эффективной концентрации и, следовательно, не оказывает терапевтического действия.
Рис. 2. Сопоставление максимальных концентраций в крови двух препаратов: МЭК — минимальная эффективная концентрация; 1 — стандартный препарат; 2 — тестируемый препарат; Сmax1, Сmax2 — соответствующие максимальные концентрации сравниваемых препаратов в крови
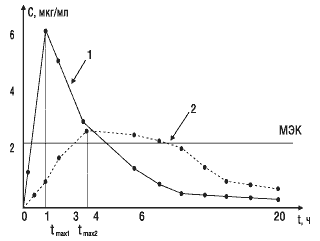
Второй важный параметр — время достижения максимальной концентрации лекарственного вещества в крови.Этот показатель отражает скорость его всасывания и скорость наступления терапевтического эффекта. На рис. 3 показано, что Сmax стандартного препарата (кривая 1) достигается через 1 ч, а тестируемого (кривая 2) — через 4 ч. Такое различие во времени достижения максимальной концентрации препарата в крови может обусловить изменение клинических показаний к применению данного препарата.
Рис.3. Сопоставление времени достижения максимальной концентрации двух препаратов: МЭК — минимальная эффективная концентрация; 1 — стандартный препарат; 2 — тестируемый препарат; tmax1, tmax2 — соответствующее время достижения максимальных концентраций сравниваемых препаратов в крови
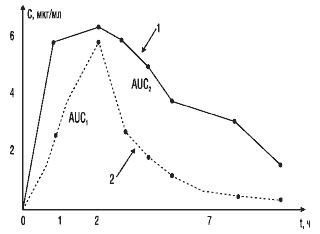
Третьим важным параметром биоэквивалентности является площадь под фармакокинетической кривой,которая отражает количество вещества, поступившего в кровь после однократного введения препарата. На рис. 3 показано, что две кривые имеют разную форму, разные пики и неодинаковое время достижения максимальной концентрации. Но площади под этими кривыми близки по величине, следовательно, оба препарата обеспечивают поступление в кровь одинакового количества лекарственного вещества.
На рис. 4 представлен другой пример соотношения кривых, отражающих кинетику двух сравниваемых препаратов. Площадь под кривой 1 практически в два раза больше, чем под кривой 2. Обращает на себя внимание то, что максимальная концентрация и время ее достижения схожи у стандартного и тестируемого препаратов. Однако площадь под фармакокинетической кривой у тестируемого препарата в 2 раза меньше за счет более быстрого выведения его из крови. В данном случае можно ожидать уменьшения длительности действия лекарственного препарата и снижения его терапевтического эффекта.
Рис. 4. Сопоставление площадей под фармакокинетическими кривыми двух препаратов: 1 — стандартный препарат; 2 — тестируемый препарат; AUC1, AUC2 — соответствующие площади под кривыми «концентрация—время» сравниваемых препаратов
Таким образом, два препарата считают биоэквивалентными, если они имеют схожие фармакокинетические показатели. По регламенту ВОЗ (1994, 1996) и ЕС (1992) их различие не должно превышать 20%.
Необходимо отметить, что планировать и проводить исследование по определению биоэквивалентности должен коллектив специалистов различных профилей: клинические фармакологи, врачи-клиницисты, биохимики, химики-аналитики, биостатистики. Все этапы проведения исследования должны быть тщательно описаны, проанализированы и представлены в подробном отчете.
Внедрение определения биоэквивалентности как метода позволяет сделать обоснованное заключение о качестве, эффективности и безопасности сравниваемых препаратов на основании меньшего объема первичной информации и в более сжатые сроки, чем при проведении клинических испытаний.
В настоящее время уже существуют регламенты изучения биоэквивалентности ВОЗ (1996), ЕС (1992), Российской Федерации (1995). В них изложены основные обоснования необходимости проведения таких исследований.
Так, изучение биоэквивалентности проводят, если:
· существует риск отсутствия биоэквивалентности и/или
· существует риск снижения фармакотерапевтического действия и клинической безопасности препарата.
Например, обязательно оценивают:
· препараты для лечения состояний, при которых необходим гарантированный терапевтический эффект;
· препараты с узким терапевтическим коридором безопасности;
· препараты, фармакокинетика которых осложнена снижением абсорбции менее 70% или с высокой элиминацией (более 70%);
· препараты с неудовлетворительными физико-химическими свойствами (низкая растворимость, нестабильность, полиморфизм);
· препараты с документированно подтвержденным существованием проблем биодоступности.
В настоящее время в Украине достаточно широко используют высокоэффективные методы для определения фармакокинетических параметров. Расширение имеющейся материально-технической базы, разработка регламента проведения исследований биоэквивалентности лекарственных веществ, подготовка специалистов в этой области позволят решить актуальную задачу по оценке эффективности и безопасности генерических препаратов отечественного и зарубежного производства.
В.И. Мальцев, А.П. Викторов,
БИЛЕТ 8
Изменение эффекта лекарственных средств при повторном применении
В клинической практике лечение пациента редко ограничивается однократным приемом лекарства. При повторном применении препаратов фармакологический эффект может нарастать или снижаться в связи с изменением чувствительности рецепторов к ним или изменением фармакокинетики. Нарастание специфического фармакологического действия при повторных введениях одного и того же лекарственного вещества называют кумуляцией. При материальной кумуляции нарастание эффекта обусловлено постоянным повышением концентрации препарата в крови и тканях из-за медленного его метаболизма и выведения. Это может быть причиной появления токсических эффектов при повторном применении терапевтических доз препарата. Опасность материальной кумуляции возрастает при нарушении функции печени и почек. Например, сердечные гликозиды группы наперстянки применяют для лечения сердечной недостаточности, которая нередко сопровождается патологией печени. В этих условиях биотрансформация препаратов замедляется и проявляется материальная кумуляция: сначала нарастание терапевтического эффекта, затем интоксикация Для предотвращения кумуляции необходимо проводить коррекцию доз (снижать) и интервалов между приемами препарата (увеличивать).
При функциональной кумуляции лекарство вызывает в организме труднообратимые или необратимые изменения, сохраняется следовая реакция, в результате повторное введение препарата может усилить эти изменения. Возникает скачкообразное усиление эффекта, хотя концентрация лекарства в крови и клетках соответствует вводимой дозе. Примером такого вида кумуляции может служить действие этилового спирта на больных алкоголизмом: синдром «белой горячки» может развиться от «обычной» дозы спирта, дипсомания (неодолимая тяга к алкоголю) провоцируется малой дозой алкоголя. Функциональная кумуляция сохраняется иногда пожизненно.
К лекарствам организм при первичном контакте может сенсибилизироваться, и тогда повторное их введение вызовет аллергические реакции (от греческого allos — другой, не специфический, ergon — действие), свидетельствующие об иммунологической несовместимости организма пациента с определенной группой химических веществ. Препараты такой структуры пациенту назначать опасно.
При повторном введении лекарств может наблюдаться и снижение специфического эффекта. Быстро возникающее (и также быстро исчезающее) понижение чувствительности организма к лекарству может быть обусловлено истощением метаболита, субстрата, через который оно реализует свой эффект — это явление называется тахифилаксией (от греческого tachys -быстрый, phylaxis -охрана). Она возникает к некоторым сосудосуживающим средствам (например, эфедрин), дыхательным аналептикам из группы Н-холиномиметиков (например, цититон). Первоначальный эффект восстановится, когда нормализуется уровень биосубстрата, с которым лекарство образует комплекс.
Ко многим лекарствам (снотворным, болеутоляющим, слабительным) при повторном применении развивается привыкание или толерантность (устойчивость). В этом случае повторное назначение терапевтических доз дает все меньший эффект. Наиболее вероятная причина — изменения фармакокинетики: уменьшение всасывания, увеличение скорости биотрансформации (индукции ферментов) и выведения. Для получения первоначального эффекта необходимо повысить дозу.
Длительное применение препаратов, действующих на центральную нервную систему и вызывающих эйфорию (эу — хорошо, фора — чувствую). может сопровождаться развитием лекарственной зависимости. Отмена препарата приводит к состоянию абстиненции (синдром «лишения»), поскольку при повторном контакте препарат, вызывающий зависимость, вероятно, включается в метаболизм нервной ткани. Различают психическую и физическую зависимость. При психической лекарственной зависимости отмена препарата вызывает эмоциональный дискомфорт и желание принять препарат становится самоцелью. При физической лекарственной зависимости наряду с психическими изменениями наблюдается нарушение функции различных органов и систем. Тяжелое состояние (абстиненция), развивающееся у пациента, не получающего соответствующий наркотик, заставляет его принимать лекарство уже не в соответствии с его истинным назначением. Причем параллельно с лекарственной зависимостью часто развивается привыкание (толерантность), и для снятия абстиненции требуются все большие дозы наркотика. С увеличением дозы усугубляется и последующий абстинентный синдром, усиливаются нарушения психических и соматических функций, развиваются хроническое отравление организма и моральная деградация личности.
Профилактика и лечение наркомании — сложная медико-социальная проблема. Лечение больных, страдающих лекарственной зависимостью, проводят в специальных учреждениях под наблюдением врачей-наркологов.
Если при психической зависимости наркотик можно отменить сразу, то при физической зависимости одномоментная отмена препарата может привести к тяжелым осложнениям, вплоть до смертельных.
Лекарственную зависимость вызывают наркотические анальгетики, кокаин, спирт этиловый, снотворные, транквилизаторы, психостимуляторы, галлюциногены и другие психотропныепрепараты.
БИЛЕТ 7
Виды действия ЛС
ДЕЙСТВИЕ ПРЕПАРАТОВ МОЖЕТ БЫТЬ:
1. МЕСТНОЕ и РЕЗОРБТИВНОЕ.
МЕСТНОЕ действие лекарственных средств развивается в месте их применения. Например, обезболивающее действие местных анестетиков новокаина, лидокаина и др.
РЕЗОРБТИВНОЕ действие препаратов развивается после всасывания в кровь и проникновения до органа — мишени через гистогематические барьеры (например: сердечные гликозиды: дигоксин, коргликон и др. оказывают свой основной положительный инотропный эффект на мышцу сердца в результате резорбтивного действия).
2. ПРЯМОЕ и НЕПРЯМОЕ (в части случаев рефлекторное действие).
Прямое действие лекарственных средств развивается непосредственно в органе — мишени. Это действие может быть местным, например: местный анестетик лидокаин оказывает местный обезболивающий эффект, и резорбтивным, например, местный анестетик лидокаин применяется в качестве антиаритмического препарата, для того, чтобы лидокаин оказал лечебный эффект при желудочковых тахиаритмиях сердца, лидокаин должен всосаться в кровь и пройти гисто- гематические барьеры до очага аритмии в ткани сердца.
Непрямое действие можно рассмотреть на примере действия сердечных гликозидов (дигоксина, строфантина и др.). Дигоксин оказывает стимулирующее влияние на сократимость сердечной мышцы, в результате увеличивается сердечный выброс. Скорость кровотока возрастает и увеличивается перфузия (кровоток) в почках. Это приводит к повышению уровня диуреза (количество мочи увеличивается). Таким образом, дигоксин косвенно увеличивает диурез через стимуляцию сократимости миокарда.
Рефлекторное действие лекарственных средств развивается в том случае, когда в одном месте организма препарат изменяет активность рецепторов, и в результате этого эффекта в другом месте организма изменяется функция органа (например: нашатырный спирт, возбуждая рецепторы слизистой носовой полости приводит к возбуждению клеток дыхательного центра головного мозга, в результате повышается частота и глубина дыхания).
- ИЗБИРАТЕЛЬНОЕ и НЕИЗБИРАТЕЛЬНОЕ.
Избирательное (элективное) действие лекарственных
средств осуществляется путем влияния на определенные рецепторы (например: празозин блокирует преимущественно Л1|-адренорецепторы) или ЛС могут накапливаться в определенном органе и оказывать присущий им эффект (например: йод избирательно накапливается в щитовидной железе, и там изменяет функцию этого органа). В клинической практике считается, что чем выше избирательность действия ЛС, тем меньше токсичность и выраженность отрицательных побочных реакций.
Неизбирательное действие препаратов, термин противоположный избирательному эффекту (например: наркозное средство фторотан неизбирательно блокирует практически все виды рецепторных образований в организме, преимущественно в нервной системе, что приводит к бессознательному состоянию, то есть наркозу).
Обратимое действие ЛС обусловлено непрочностью химических взаимодействий с рецепторными образованиями или ферментами (водородные связи и др.; например: антихо- линэстеразное средство обратимого типа действия — прозерин). Необратимое действие наступает, когда с рецепторами или ферментами ЛС связывается прочно (ковалентные связи; например: антихолинэстеразное средство необратимого типа действия — армин). 5. ГЛАВНОЕ и ПОБОЧНОЕ. Главное действие ЛС — это эффект препарата, направленный на лечение основного заболевания (например: доксазозин — альфа-1-адреноблокатор применяется для лечения гипертонической болезни). Побочное действие — это эффекты препарата не направленные на лечение основного заболевания. Побочное действие может быть ПОЛОЖИТЕЛЬНЫМ (например: доксазозин при курсовом лечении гипертонической болезни тормозит рост предстательной железы и нормализует тонус сфинктера мочевого пузыря, и, следовательно, может применяться при аденоме предстательной железы и нарушениях мочеиспускания) и ОТРИЦАТЕЛЬНЫМ (например: доксазозин может вызывать преходящую тахикардию при лечении гипертонической болезни, а также часто регистрируют синдром отмены). АГОНИСТЫ — лекарственные средства, возбуждающие рецепторные образования. Например: орциприналина сульфат (асмопент) стимулирует р 2 -адренорецепторы бронхов и приводит к расширению просвета бронхов. АНТАГОНИСТЫ — лекарственные средства, блокирующие возбуждение рецепторов (метопролол блокирует бета-1-адренорецепторы в мышце сердца и уменьшает силу сердечных сокращении). АГОНИСТЫ-АНТАГОНИСТЫ — лекарственные средства, обладающие свойствами как возбуждать, так и угнетать рецепторные образования. Например: пиндолол (вискен) блокирует бета-1- и бета-2-адренорецепторы. Однако пиндолол обладает так называемой «внутренней симпатомиметической активностью», то есть препарат, блокируя бета- адренорецепторы и препятствуя определенное время воздействию медиатора на эти рецепторы, оказывает и некоторое стимулирующее влияние на те же бета- адренорецепторы. Дозы лекарственных средств
БИЛЕТ 6
Основное и побочное действие ЛС
Основное действие. Действие, ради которого применяется лекарственное вещество при лечении данного заболевания. Например, фенитоин (дифенин) обладает противосудорожными и антиаритмическими свойствами. У больного эпилепсией основным действием фенитоина является противосудорожное, а у больного с сердечной аритмией, вызванной передозировкой сердечных гликози- дов — антиаритмическое.
Все остальные эффекты лекарственного вещества (кроме основного), которые возникают при его приеме в терапевтических дозах, расцениваются как проявления побочного действия. Эти эффекты часто бывают неблагоприятными (отрицательными) (см. главу 5). Например, ацетилсалициловая кислота может вызвать изъязвление слизистой оболочки желудка, антибиотики из группы аминогликозидов (канамицин, гентамицин и др.) — нарушать слух. Отрицательное побочное действие часто является причиной ограничения применения того или иного лекарственного вещества и даже исключения его из списка лекарственных препаратов.
екарственные средства назначают для достижения определенного фармакотерапевтического эффекта (обезболивания, снижения АД и т. д.). Все это является проявлением основного действия препаратов. Однако наряду с желательными эффектами любые лекарственные вещества могут оказывать и неблагоприятное воздействие (побочные реакции неаллергической природы, аллергические реакции, токсические и другие эффекты).
К проявлениям побочного действия неаллергического происхождения относят только те эффекты, которые возникают при применении веществ в терапевтических дозах и составляют спектр их фармакологического действия. Так, фенобарбитал при использовании в качестве противоэпилептического препарата может быть причиной сонливости.
Побочное действие может быть первичным или вторичным. Первичное действие возникает как прямое следствие влияния данного препарата на определенный субстрат (тошнота и рвота при раздражающем действии на слизистую оболочку желудка). Вторичное действие относится к косвенно возникающим неблагоприятным влияниям (гиповитаминоз при подавлении кишечной флоры антибиотиками).
Аллергические реакции возникают независимо от дозы вводимого вещества и подразделяются на 4 типа:
- тип I (немедленная аллергия) — проявляется крапивницей, сосудистым отеком, ринитом, бронхоспазмом и анафилактическим шоком. Такая реакция возможна при применении пенициллинов и сульфаниламидов;
- тип II — через систему комплемента IgG и IgM взаимодействуют с клетками крови, вызывая их лизис. Так, метилдофа может вызывать гемолитическую анемию, а анальгин — агранулоцитоз;
- тип III — комплекс антиген-антитело-комплемент повреждает сосудистый эндотелий. Возникает сывороточная болезнь (крапивница, артралгия, артрит, лимфаденопатия, лихорадка). Подобную реакцию вызывают пенициллины, сульфаниламиды, йодиды;
- тип IV — возникает при местном нанесении вещества и проявляется контактным дерматитом.
Идиосинкразия — атипичная реакция организма на лекарственное вещество. Является одним из видов неблагоприятной реакции на вещества. Токсическое действие наблюдаются при передозировке, отравлениях или накоплении токсических веществ при нарушении их метаболизма (патология печени и почек).
Тератогенное действие — отрицательное действие лекарственных веществ на плод и эмбрион, приводящее к рождению детей с аномалиями. Наиболее опасное время беременности — первый триместр (3-8-я недели).
Эмбриотоксическое действие — неблагоприятное воздействие на эмбрион до 12 недель беременности, не связанное с нарушением органогенеза (не относится к тератогенному действию). Фетотоксическое действие — неблагоприятное воздействие на эмбрион после 12 недель беременности, также не связанное с нарушением органогенеза.
Мутагенность — способность повреждать генетический аппарат клетки и вызывать мутации. Канцерогенность — способность лекарственных веществ вызывать развитие злокачественных опухолей.
Лекарственная несовместимость — неблагоприятные эффекты лекарственных веществ, возникшие при их сочетанном действии.
БИЛЕТ 5
Пути выведения лекарственных средств из организма. Клиническое значение.
Л.В. выводятся из организма либо в неизменном виде, либо в виде метаболитов и конъюгатов.
1. Основной путь – выведение через почки с мочой
А) полярные, водорастворимые вещества легко фильтруются в клубочках и быстро выводятся;
Б) неполярные, липофильные вещества после фильтрации возвращаются опять в кровь. Затем поступают в печень и подвергаются БТ. Образовавшиеся водорастворимые метаболиты выводятся через почки. Полярные вещества плохо реабсорбируются, а неполярные вещества хорошо
Через почки выводится только свободная фракция лекарства, не связанная с белками. Имеет значение рН мочи, см.выше.
При заболевании почек их способность выводить лекарственные вещества снижается.
2. Через ЖКТ
а) через кишечник – выводятся вещества, которые не всасываются в ЖКТ (фталазол, активизированный уголь);


Некоторые вещества выделяющиеся с желчью, могут повторно всасываться в кровь и в дальнейшем вновь выделяться в кишечник и так несколько раз (кишечно-печеночная циркуляция)
в) через эпителий ЖКТ может идти секреция веществ из плазмы крови в просвет кишечника (тяжелые металлы, сенна)
3. Через легкие– газообразные или летучие вещества (средства для наркоза,NH4OH,C2Н5ОН).
4. Через секреты желез
· со слюной – эритромецин, иодиды, ампициллин, Bi;
· с потом – пенициллины, гриозеофульвин;
· со слезами – рифампицин;
· через кожу – соли тяжелых металлов;
· с молоком матери – седативные, снотворные, анальгетики, алкоголь, никотин, противомикробные средства, глюкокортикоиды и др
БИЛЕТ 4
Механизмы всасывания ЛС.
ОСНОВНЫЕ МЕХАНИЗМЫ ВСАСЫВАНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ (ЛС)
Всасывание – это процесс поступления ЛС из места введения в кровь. Всасывание лекарственного вещества зависит от пути введения его в организм, лекарственной формы, физико-химических свойств (растворимости в липидах или гидрофильности вещества), а также от интенсивности кровотока в месте введения.
ЛС, принятые перорально, подвергаются всасыванию, проходя через слизистую оболочку желудочно-кишечного тракта, что определяется их растворимостью в липидах и степенью ионизации. Различают 4 основные механизма всасывания: диффузия, фильтрация, активный транспорт, пиноцитоз.
Пассивная диффузия осуществляется через клеточную мембрану. Всасывание происходит до тех пор, пока концентрация лекарственного вещества по обе стороны биомембраны не сравняется. Подобным образом всасываются липофильные вещества (например, барбитураты, бензодиазепины, метопролол и др.), причем чем выше их липофильность, тем активнее их проникновение через клеточную мембрану. Пассивная диффузия веществ идет без затраты энергии по градиенту концентрации.
Облегченная диффузия – это транспорт лекарственных веществ через биологические мембраны с участием молекул специфических переносчиков. При этом перенос лекарства осуществляется также по градиенту концентрации, но скорость переноса при этом значительно выше. Например, таким образом всасывается цианокобаламин. В осуществлении его диффузии участвует специфический белок – гастромукопротеид (внутренний фактор Кастла), образующийся в желудке. Если продукция этого соединения нарушена, то снижается всасывание цианокобаламина и, как следствие этого, развивается пернициозная анемия.
Фильтрация осуществляется через поры клеточных мембран. Этот механизм пассивного всасывания идет без затраты энергии и осуществляется по градиенту концентрации. Характерен для гидрофильных веществ (например, атенолол, лизиноприл и др.), а также ионизированных соединений.
Активный транспорт осуществляется с участием специфических транспортных систем клеточных мембран. В отличие от пассивной диффузии и фильтрации активный транспорт процесс энергозатратный и способен осуществляться против градиента концентрации. В данном случае несколько веществ могут конкурировать за один и тот же транспортный механизм. Способы активного транспорта обладают высокой специфичностью, поскольку сформировались в процессе длительной эволюции организма для обеспечения его физиологических потребностей. Именно эти механизмы являются основными для осуществления доставки в клетки питательных веществ и выведения продуктов обмена.
Пиноцитоз (корпускулярная абсорбция или пенсорбция) представляет также разновидность всасывания с затратой энергии, осуществление которого возможно против градиента концентрации. При этом происходит захват лекарственного вещества и инвагинация клеточной мембраны с образованием вакуоли, которая направляется к противоположной стороне клетки, где происходит экзоцитоз с высвобождением лекарственного соединения.
БИЛЕТ 3
Фармакокинетика– это раздел фармакологии, который изучает различные этапы прохождения распределение по органам и тканям, биотрансформация, выведение ЛС из организма.
Фармакокинетика лекарственных средств в организме представлены этапами, связанными с:
· Проникновением – регулируются процессами диффузии (смешивание различных веществ до однородного состояния), фильтрации и активного транспорта (движение некоторых медикаментозных веществ в клетки и из них против концентрационного реагента)
· Всасыванием – действие, связанное с поступлением медикамента в кровь. Определяется лекарственной формой, растворимостью, кровотоком в месте введения
· Распределение – определяется растворимостью препарата в липидах, связью между белками крови и кровотоком
· Биотрансформацией – процесс биохимических и физико-химических действий. Как правило, на биотрансформацию влияют заболевания печени, особенности питания, возраст и др.
· Существуют разные пути введения лекарственного средства в организм. Их можно разделить на 2 большие группы: энтеральный (через желудочно-кишечный тракт), парентеральный (минуя желудочно-кишечный тракт). К энтеральным путям введения относят: пероральный (peros– через рот), сублингвальный (под язык), через зонд в желудок и двенадцатиперстную кишку, ректальный (через прямую кишку). К парентеральным путям введения относятся: накожный, внутрикожный, подкожный, внутримышечный, внутривенный, внутриартериальный, внутрисердечный, под оболочки мозга, ингаляционный, интрастернальный (в грудину). Каждый из путей введения имеет свои преимущества и недостатки.
· Самый распространенный путь введения – это через рот (пероральный). Этот путь удобный, простой, не требуется стерильность препаратов. Всасывание лекарственного вещества идет частично в желудке, частично в кишечнике. Однако некоторые лекарственные вещества могут разрушаться под действием желудочного сока. В этом случае лекарственное вещество помещают в капсулы, которые не разрушаются желудочным соком. Под языком лекарственное средство всасывается быстро, минует печень и не вступает в контакт с содержимым желудка и кишечника (Нитроглицерин). При ректальном способе введения (суппозитории, клизмы) лекарственное вещество быстро всасывается, частично минуя печень. Однако, далеко не все препараты хорошо всасываются из слизистой прямой кишки, а некоторые препараты могут раздражать слизистые оболочки.
· Из парентеральных путей введения чаще используют: под кожу, внутримышечный, внутривенный. Быстрый эффект наступает при внутривенном пути введения. Однако к трудностям парентеральных способов введения относят: болезненность укола, стерильность препаратов и шприцов, необходимость медицинского персонала для проведения инъекций.
· Поступив в организм, лекарственное вещество должно всосаться. Всасывание (абсорбция) – это процесс поступления лекарственного вещества в кровеносную или лимфатическую систему из места введения. Основные механизмы всасывания: пассивная диффузия, облегченная диффузия, активный транспорт, пиноцитоз. Факторы, влияющие на всасывание лекарственного вещества при приеме внутрь: растворимость, лекарственная форма, pHжелудка и кишечника, активность ферментов желудочно-кишечного тракта, перистальтика желудочно-кишечного тракта, прием пищи, мальабсорбция, дисбактериоз.
· После всасывания лекарственного вещества в кровь оно будет циркулировать там, в «свободной» или «связанной» форме. «Свободная» форма (не связана с белками крови) растворима в водной фазе плазмы крови. Эта форма легко проникает через стенку капилляров в ткани и оказывает фармакологический эффект. «Связанная» форма – это часть лекарственного вещества, которая связана с белками крови (чаще с альбуминами) и неспособна, проникать в ткани. Эта форма представляет собой как бы депо препарата и по мере выведения лекарственного вещества из организма отщепляется от белка и переходит в «свободную» форму. Следовательно: только «свободная» форма лекарственного вещества оказывает фармакологический эффект.
· После всасывания в кровь лекарственное вещество подвергается распределению по органам и тканям. Распределение по органам и тканям чаще всего бывает неравномерным. Степень поступления в ту или иную ткань зависит от разных факторов: от молекулярной массы, от растворимости в воде и липидах, от степени диссоциации; от возраста, пола; от массы жировых депо; от функционального состояния печени, почек, сердца; от способности преодолевать гистогематические барьеры.
· К гистогематическим барьерам относят: капиллярную стенку, гематоэнцефалический барьер, гематоофтальмический барьер, плацентарный барьер. Капилляры легко проницаемы для лекарственных веществ, так как стенка капилляров имеет широкие поры, через которые легко проходят водорастворимые вещества с молекулярной массой не больше инсулина (5 – 6 кДа). А жирорастворимые вещества диффундируют через мембрану клеток.
· Гематоэнцефалический барьер – представляет собой капиллярную стенку, которая является многослойной мембраной (эндотелий, межуточное вещество и глиальные клетки головного и спинного мозга). Такая мембрана лишена пор. Через гематоэнцефалический барьер легко проникают липофильные вещества путем простой диффузии (например, тиопентал натрия – наркозное средство). Для полярных соединений (пенициллины, миорелаксанты) гематоэнцефалический барьер не проницаем. Гематоэнцефалический барьер гипоталамуса, гипофиза отличается повышенной проницаемостью для лекарственных веществ. Проницаемость гематоэнцефалического барьера повышается при менингите, арахноидите, гипоксии, черепно-мозговых травмах. Некоторые лекарственные препараты (кофеин, эуфиллин, лидаза) повышают проницаемость гематоэнцефалического барьера.
· Гематоофтальмический барьер отделяет кровь капилляров от внутриглазной жидкости в камерах глаза. В камеры глаза хорошо проходят липофильные препараты.
· Плацентарный барьер разделяет кровообращение матери и плода. На ранних стадиях беременности наблюдается большая порозность этого барьера и многие лекарства легко проникают в плод. Затем этот барьер «укрепляется» и приобретает свойства липидной мембраны. Но с 33 – 35-й недели беременности истончается плацента и значительно повышается проницаемость плацентарного барьера. Это создает опасную ситуацию для плода. Не проникают через плацентарный барьер крупномолекулярные вещества (инсулин, полиглюкин), а также гидрофильные ионизированные молекулы: миорелаксанты, ганглиблокаторы.
· Следующий этап фармакокинетики – это элиминация лекарственного вещества. Элиминация (от латинского eliminatum– удалять) – удаление лекарств из организма путем биотрансформации и экскреции.
· Биотрансформация – это метаболическое превращение лекарств, в результате которых они приобретают полярные группы, то есть уменьшается растворимость в липидах и возрастает растворимость в воде. Полярные метаболиты пригодны к удалению из организма. Для примера хочу сказать, что если бы не было метаболизма, то одна терапевтическая доза снотворного средства этаминала могла бы находиться в организме 100 лет. Биотрансформация лекарств чаще всего (90 – 95%) происходит в печени, реже в слизистой оболочке кишечника, почках, легких, коже, в крови. Наиболее изучен метаболизм лекарств в печени. Метаболизм в печени происходит: либо в эндоплазматическом ретикулуме гепатоцитов с помощью микросомальных оксидаз смешанной функции либо вне эндоплазматического ретикулума (в митохондриях) с помощью немикросомальных ферментов
Фармакодинамика
Фармакодинамика (от греческого «pharmakon» — лекарство, «dynamikos» — сильный) — раздел фармакологии, рассматривающий совокупность эффективности лекарственных средств, механизмы их действия на организм человека, а так же взаимосвязь концентрации лекарственных веществ с достигнутым действием их на организм.
Так достигаемые эффекты отражаются в простом уравнения L + R L*R, где L — это лекарство, а R — это рецептор (место приложения действия). В этом и заключается определение фармакодинамики.
Методы для изучения фармакодинамики:
Ключевой момент в методике изучения это следующие важные свойства:
а) высокая чувствительность — способность выявлять большую часть отклонений от исходного состояния, и динамику положительных изменения в организме.
б) высокая специфичность — способность редко давать «ложноположительные» результаты.
в) высокая воспроизводимость — способность стабильно отображать характеристики состояния больных при повторных исследованиях у одних и тех же пациентов и одинаковых условиях при отсутствии какой-либо динамики в состоянии этих больных по другим клиническим данным.
Видео:Общая фармакология.Скачать

Математическое моделирование фармакокинетических процессов
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
МАТЕМАТИЧЕСКОЕ МОДЕЛИРОВАНИЕ ФАРМАКОКИНЕТИЧЕСКИХ ПРОЦЕССОВ
Величина и продолжительность фармакологического эффекта во многом определяется концентрацией лекарственного вещества (ЛВ) в тех органах или тканях, где оно оказывает свое действие. Поэтому очень важно поддерживать определенную (терапевтическую) концентрацию ЛВ в месте его действия. Однако в
большинстве случаев концентрацию вещества в тканях определить практически невозможно, поэтому при фармакокинетических исследованиях определяют концентрации ЛВ в плазме крови, которые для большинства веществ коррелируют с их концентрациями в органах-мишенях.
В результате всасывания, распределения, депонирования и элиминации (биотрансформации и выведения) ЛВ его концентрация в плазме крови изменяется. Эти изменения могут быть отражены графически. Для этого концентрацию лекарственного вещества измеряют в плазме крови сразу и через определенные промежутки времени после его введения и на основании полученных данных строят кривую изменения концентрации ЛВ во времени, или так называемую фармакокинетическую кривую (рис. 1.6).
Для того чтобы количественно оценить влияние процессов всасывания, распределения депонирования и элиминации на концентрацию ЛВ в крови, используют математические фармакокинетические модели. Различают однокамерные, двухкамерные и многокамерные фармакокинетические модели.
В однокамерной модели организм условно представляют в виде камеры, заполненной жидкостью. Вещество может поступать в камеру постепенно, как при введении внутрь (или других внесосудистых путях введения), или мгновенно, как при быстром внутривенном введении (рис. 1.7).
После поступления вещества в камеру в количестве D оно распределяется мгновенно и равномерно и занимает объем камеры, при этом концентрация вещества, которая создается в камере, обозначается как начальная концентрация – С0. Объем распределения вещества в камере – Vd (volume of distribution) = D/C0.
В клинической практике используют параметр, который получил название кажущийся объем распределения (apparent volume of distribution, Vd).
Кажущийся объем распределения – гипотетический объем жидкости организма, в котором лекарственное вещество распределено равномерно и при этом находится в концентрации, равной концентрации данного вещества в плазме крови (С ). Соответственно, кажущийся объем распределения Vd = Q/C где Q — количество вещества в организме при концентрации в плазме крови С .
Если допустить, что вещество после внутривенного введения в дозе D мгновенно и равномерно распределилось в организме, то кажущийся объем распределения Vd = D/C0, где С0 – начальная концентрация вещества в плазме крови.
Кажущийся объем распределения позволяет судить о том, в каком соотношении распределяется вещество между жидкостями организма (плазмой крови, интерстициальной, внутриклеточной жидкостями). Так, если величина Vd какого-либо вещества имеет значение, приблизительно равное 3 л (средний объем плазмы
крови), это значит, что данное вещество преимущественно находится в плазме крови. Такой объем распределения характерен для крупномолекулярных соединений, которые практически не проникают в клетки крови и через эндотелий сосудов (не выходят за пределы сосудистого русла), например, для гепарина (Vd — около 4 л).
Если Vd равен 15 л (сумма средних объемов плазмы крови и интерстициальной жидкости), вещество преимущественно находится в плазме крови и интерстициальной жидкости (во внеклеточной жидкости), т.е. не проникает внутрь клеток. Предположительно это гидрофильное соединение, которое не проходит через клеточные мембраны. К таким веществам относятся аминогликозидные антибиотики (гентамицин, тобрамицин). Поэтому эти антибиотики практически не оказывают действие на микроорганизмы, находящиеся внутри клеток, т.е. неэффективны в отношении внутриклеточных инфекций.
Некоторые лекарственные вещества имеют объем распределения порядка 40 л (средний объем всех жидкостей организма). Это означает, что они находятся как во внеклеточной, так и во внутриклеточной жидкостях организма, т.е. проникают через мембраны клеток. В основном так распределяются в организме липофильные неполярные соединения.
Если величина Vd лекарственного вещества значительно превышает объем жидкостей организма, это вещество скорее всего депонировалось в периферических тканях, и его концентрация в плазме крови чрезвычайно мала. Большие значения объема распределения характерны для трициклических антидепрессантов имипрамина и амитриптилина (Vd — порядка 1600 л ). Такие Л В не могут быть эффективно удалены из организма с помощью гемодиализа.
После мгновенного и равномерного распределения вещества в объеме камеры и достижения концентрации С0 концентрация вещества в камере постепенно снижается при участии двух процессов — биотрансформации и экскреции (см. рис. 1.7). Оба эти процесса объединяются термином элиминация.
Для большинства лекарственных веществ скорость элиминации зависит от концентрации вещества (чем меньше концентрация вещества, тем меньше скорость элиминации). При этом кривая изменения концентрации вещества во времени имеет экспоненциальный характер (рис. 1.8). Такая элиминация соответствует кинетике 1-го порядка (в единицу времени элиминируется определенная часть вещества^.
Основными параметрами, характеризующими процесс элиминации, являются константа скорости элиминации (kel, ke) и период полуэлиминации (t1/2).
Константа скорости элиминации 1-го порядка показывает, какая часть вещества элиминируется из организма в единицу времени (размерность мин -1 , ч -1 ). Например, если keI какого-либо вещества, которое ввели внутривенно в дозе 100 мг, составляет 0,1 ч
’, то через 1 ч количество вещества в крови будет равно 90 мг, а через 2 ч – 81 мг и т.д.
Немногие лекарственные вещества (этанол, фенитоин) элиминируются в соответствии с кинетикой нулевого порядка. Скорость такой элиминации не зависит от концентрации вещества и является постоянной величиной, т.е. в единицу времени элиминируется определенное количество вещества (например, за 1 ч элиминируется 10 г чистого этанола). Связано это с тем, что при терапевтических концентрациях названных веществ в крови происходит насыщение ферментов, метаболизирующих эти вещества. Поэтому при увеличении концентрации таких веществ в крови скорость их элиминации не повышается.
Период полуэлиминации (tI/2, half-life) – время, за которое концентрация вещества в плазме крови снижается на 50% (рис. 1.9). Для большинства ЛВ (для тех, элиминация которых подчиняется кинетике 1-го порядка) период полуэлиминации – величина постоянная в определенных пределах и не зависит от дозы ЛВ. Поэтому, если за один период полуэлиминации из плазмы крови удаляется 50% внутривенно введенного ЛВ, то за 2 периода — 75%, а за 3,3 периода – 90% (этот параметр используют для подбора интервалов между введениями вещества, необходимых для поддержания его постоянной концентрации в крови).
Период полуэлиминации связан с константой скорости элиминации следующим соотношением:
Если сразу же после внутривенного введения вещества производить измерения его концентрации в плазме крови через короткие интервалы времени, то можно получить двухфазный характер изменения концентрации вещества в крови (см. рис. 1.11).
Такой же характер кривой можно получить с помощью двухкамерной фармакокинетической модели (рис. 1.10). В этой модели организм представляют в виде двух сообщающихся между собой камер. Одна из камер этой модели называется центральной и представляет плазму крови и хорошо перфузируемые органы (сердце, печень, почки, легкие), а другая, называемая периферической, представляет
плохо перфузируемые ткани (кожу, жировую, мышечную ткани). Вещество вводят в центральную камеру, где оно мгновенно и равномерно распределяется и откуда затем проникает в периферическую камеру. Этот период обозначается как фаза распределения, или α-фаза. Затем вещество перераспределяется из периферической камеры в центральную и удаляется из нее вследствие элиминации. Эта фаза (фаза элиминации) обозначается как β-фаза. α-Фаза характеризуется параметром, который называется периодом полураспределения – t1/2(X, а характеристикой β-фазы является собственно период полуэлиминации, обозначаемый как t1/2g (рис. 1.11). Период полураспределения, как правило, меньше периода полуэлиминации, так как вещество распределяется из центральной камеры в периферическую быстрее, чем элиминируется.
Клиренс — фармакокинетический параметр, который характеризует скорость освобождения организма от лекарственного вещества.
Поскольку освобождение организма от ЛВ происходит за счет процессов биотрансформации (метаболизма) и экскреции, различают метаболический и экскреторный клиренс. Метаболический клиренс (Clmet) и экскреторный клиренс (Сехсг) в сумме составляют системный (общий) клиренс (Clt, total clearance):
Системный клиренс численно равен объему распределения, который освобождается от вещества в единицу времени (размерность — объем в единицу времени, например, мл/мин, л/ч, иногда с учетом массы тела, например, мл/кг/мин):
Значения клиренса прямо пропорциональны скорости элиминации вещества и обратно пропорциональны его концентрации в биологической жидкости (в крови, плазме крови, сыворотке):
где С – концентрация вещества.
В зависимости от путей элиминации Л В различают почечный клиренс (С1геп), печеночный клиренс (Clhep), а также клиренс, осуществляемый другими органами (легкими, слюнными, потовыми и молочными железами, внепеченочный метаболизм). Наиболее важными составляющими системного клиренса являются почечный и печеночный клиренс.
Почечный клиренс численно равен объему плазмы крови, который освобождается от ЛВ в единицу времени и зависит от интенсивности процессов клубочковой фильтрации, канальцевой секреции и реабсорбции. Почечный клиренс можно определить при постоянной концентрации вещества в плазме крови:
где Cu – концентрация вещества в моче, С — концентрация вещества в плазме крови и Vu – скорость мочеотделения.
Печеночный клиренс зависит от процессов биотрансформации ЛВ и экскреции неизмененного Л В с желчью. Значения почечного и печеночного клиренса следует учитывать при назначении ЛВ больным с недостаточностью почек или печени соответственно.
Оптимизация дозирования лекарственных веществ
Для достижения оптимального терапевтического эффекта ЛВ необходимо постоянно поддерживать его терапевтическую концентрацию в крови. Постоянно поддерживаемый уровень вещества в плазме крови обозначается как стационарная концентрация (Css, С steady-state). Стационарная концентрация устанавливается при достижении равновесия между процессом поступления вещества в системный кровоток и процессом его элиминации (когда скорость поступления равна скорости элиминации). Наиболее простым способом достижения стационарной концентрации является внутривенное капельное введение (рис. 1.12). При внутривенном капельном введении величина Css зависит от скорости введения вещества, которую можно определить по формуле D/T = С CI.
ЛВ необходимо вводить с такой скоростью, чтобы поддерживать его терапевтическую концентрацию в крови. Существует диапазон терапевтических концентраций (рис. 1.13). Нижняя граница этого диапазона — минимальная эффективная концентрация (Сss, ниже этой концентрации вещество не оказывает необходимого действия), верхняя граница – максимальная безопасная концентрация (Сss, выше которой находится область токсических концентраций). Обычно поддерживают среднюю концентрацию этого диапазона, т.е. среднюю терапевтическую концентрацию вещества в крови. Значения средних терапевтических концентраций лекарственных веществ приводятся в справочной литературе.
Время достижения стационарной терапевтической концентрации вещества в крови зависит от его периода полуэлиминации. Через период полуэлиминации достигается 50%, через 2 периода полуэлиминации – 75% и через 3,3 периода — 90% от стационарного уровня вещества в крови. Поэтому при необходимости получения быстрого терапевтического эффекта, в особенности если вещество имеет достаточно большой период полуэлиминации, вначале вводят большую нагрузочную дозу препарата (для достижения стационарной терапевтической концентрации), а затем вещество вводят инфузионно с определенной скоростью для поддержания стационарной концентрации. Однако чаще всего вещества назначают отдельными дозами через определенные интервалы времени (наиболее часто вещества назначают внутрь). В таких случаях концентрация вещества в крови не остается постоянной, а меняется относительно стационарного уровня, причем эти колебания не должны выходить за пределы диапазона терапевтических концентраций. Поэтому после назначения нагрузочной дозы, которая обеспечивает быстрое достижение стационарной терапевтической концентрации, вводят меньшие по величине поддерживающие дозы, которые должны обеспечить лишь небольшие колебания концентрации вещества в крови относительно его стационарного терапевтического уровня (рис. 1.14). Нагрузочную и поддерживающую дозы ЛВ для каждого конкретного больного можно рассчитать по формулам, в которых использованы фармакокинетические параметры, представленные в этом разделе: объем распределения, период полуэлиминации и др. При введении веществ внутрь учитывается степень всасывания ЛВ из желудочно-кишечного тракта, которую характеризует такой параметр, как биодоступность (часть введенной дозы вещества, которая в неизмененном виде достигла системного кровотока).
Биодоступность веществ при введении внутрь зависит от многих факторов (см. стр. 33) и определяется следующим образом. Вещество вводят больному внутривенно и измеряют его концентрацию в крови через определенные промежутки времени. На основании полученных данных вычерчивают кривую изменения концентрации вещества во времени при внутривенном введении. Затем тому же больному это вещество вводят внутрь в той же дозе и определяют его концентрацию в крови через определенные интервалы времени. По результатам измерения строят кривую изменения концентрации вещества во времени при введении внутрь (рис. 1.15).
Затем измеряют площади под кривыми концентрация – время (AUC, Area Under the Curve). Биодоступность вещества определяют по формуле:
где F – биодоступность (Fraction); AUC – площадь под кривой концентрация—время (Area Under the Curve).
💥 Видео
Фармакокинетика. 02.09.21Скачать

Ингавирин капсулы 90мг 10 штСкачать

#9 Фармакокинетические параметры.Биодоступность. Клиренс. Период полувыведения. Константа элиминацииСкачать

Основы фармакокинетики. Олег ТалибовСкачать

Практический навык Внутривенное капельное введение лекарственных средствСкачать
Несоответствия GDP в процессе дистрибуции лекарственных средствСкачать
Фармакокинетика. Часть 1. Абсорбция. Распределение. 09.02.21Скачать

НПО - фармакология урок 20 - АНТИБИОТИКИ ЧАСТЬ 1Скачать

[EN] KB 001613 | Расчет на огнестойкость с помощью параметрической кривой температура-время согла...Скачать
![[EN] KB 001613 | Расчет на огнестойкость с помощью параметрической кривой температура-время согла...](https://i.ytimg.com/vi/K3l38Y7hoxo/0.jpg)
Фармакокинетика | Общая фармакологияСкачать

внутривенное капельное введение лекарственных средств.Скачать

Порядок работы на кондуктометре КСЛ 101Скачать

Мастер класс Контроль качества лекарственных формСкачать

Мнение Верховного суда о порядке расчета объема водоотведенияСкачать

53 Внутрикожная инъекцияСкачать
Урок 10. Применение коэффициентовСкачать

Внутривенное капельное введение лекарственных средствСкачать