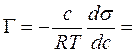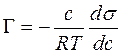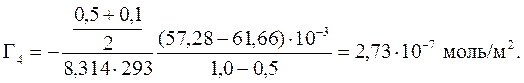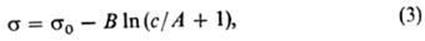Видео:16 Урок_Виды межмолекулярных связей_Поверхностно-активные вещества (ПАВ)Скачать

Определение площади, занимаемой молекулой поверхностно-активного вещества в насыщенном адсорбционном слое, и максимальной длины молекулы ПАВ
Если известна величина Г¥, то можно рассчитать площадь, занимаемую одной молекулойПАВ в насыщенном монослое S0
 . . | (318) |
где NA = 6,02×10 23 моль –1 – число Авогадро.
Толщина адсорбционного слоя, равная длине молекулы, рассчитывается по уравнению:
 , , | (319) |
где М – относительная молекулярная масса ПАВ; r – плотность ПАВ в жидком состоянии (Приложение 19).
Уравнение Шишковского
Зависимость поверхностного натяжения раствора ПАВ от его концентрации в растворе описывается уравнением Шишковского
 , , | (320) |
где В – эмпирическая константа, постоянная для данного гомологического ряда, которая равна
| В= RTГ∞ | (321) |
Поэтому уравнение Шишковского можно записать следующим образом:
 , , | (322) |
где G¥ – величина предельной адсорбции ПАВ в мономолекулярном слое на границе «ж – г», моль/м 2 ; K – константа адсорбционного равновесия, л/моль; с – концентрация ПАВ в растворе, моль/л.
В области концентрированных растворов, для которых Kc >> 1 уравнение Шишковского принимает вид:
 . . | (323) |
Это уравнение линейно в координатах «s – lnс». По графику, построенному в этих координатах (рис. 73), можно рассчитать константы G¥ и K, входящие в уравнение Шишковского и Ленгмюра.
Рис. 73. Схема расчёта констант в уравнении Шишковского в области концентраций Kс>>1 с помощью линеаризации уравнения
Правило Дюкло – Траубе
Влияние природы ПАВ на их поверхностную активность описывается правилом Дюкло-Траубе:
Ø В пределах одного гомологического ряда поверхностная активность ПАВ увеличивается в 3 – 3,5 раза при удлинении гидрофобной части на одну метиленовую группу (-СН2-).
Правилу Дюкло – Траубе соответствует уравнение:
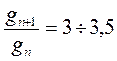 , , | (324) |
где gn – поверхностная активность ПАВ, содержащего n -CH2— групп, gn+1 – поверхностная активность ПАВ, содержащего n+1 ‑CH2— групп.
Правило Дюкло – Траубе выполняется вследствие того, что в пределах одного гомологического ряда ПАВ объем, занимаемый одной ‑CH2— группой постоянен.
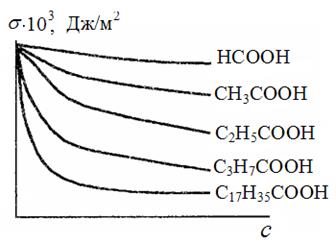
Из рисунка (74) видно, что чем длиннее углеводородная цепь, тем быстрее снижается σ водного раствора с ростом концентрации ПАВ.
Рис. 74. Изотермы поверхностного натяжения для водных растворов карбоновых кислот при 298 К
Примеры решения задач
1. Определить адсорбцию (мкмоль/м 2 ) при 10°С для раствора, содержащего 50 мг пеларгоновой кислоты С8Н17СООН. Поверхностное натяжение исследуемого раствора 57,0×10 –3 Дж/м 2 . Считать, что поверхностное натяжение изменяется в указанном диапазоне концентраций линейно.
Находим 
Молярная концентрация кислоты в растворе равна:

По уравнению Гиббса (310) рассчитаем адсорбцию раствора пеларгоновой кислоты:
2. По уравнению Шишковского рассчитать поверхностное натяжение водного раствора масляной кислоты с концентрацией 0,104 моль/л при 273 К. Поверхностное натяжение воды при той же температуре 75,62×10 –3 Дж/м 2 . Константы уравнения Шишковского B = 12,6×10 3 Дж/м 2 , K = 21,5 л/моль.
По уравнению Шишковского (322), рассчитываем поверхностное натяжение водного раствора масляной кислоты, учитывая, что константа В определяется по уравнению (321):

3. Найдите значение адсорбции и площади, занимаемой одним ммолем уксусной кислоты при различных концентрациях, если при определении поверхностного натяжения растворов уксусной кислоты при 20°С были получены следующие результаты:
| с, моль/л | 0,01 | 0,1 | 0,5 | 1,0 | |
| σ, мДж/м 2 | 72,26 | 70,02 | 66,88 | 61,66 | 57,28 |
Рассчитываем величину адсорбции уксусной кислоты по уравнению (310):
Рассчитаем площадь, занимаемую одним ммолем уксусной кислоты при заданных концентрациях, по уравнению, которое следует из уравнения (318):
Видео:Поверхностно-активные веществаСкачать

1.6. Строение и свойства адсорбционных слоев на границе раздела «водный раствор-воздух»
В 1916–1917 гг. американские ученые Ленгмюр и Гаркинс выдвинули предположение, что молекулы ПАВ имеют дифильное строение, т.е. состоят из двух частей — полярной и неполярной. В дальнейшем это предположение полностью подтвердилось. Эти ученые предложили обозначить молекулу ПАВ, например R-CООH, как приведено на рис. 1.17, где а – полярная часть молекулы, обеспечивающая ее склонность к гидратации, ассоциации и т.д., например группы -ОН, -NH2, -СООН, кислородсодержащие эфирные группы -ОС2Н4-, группы, содержащие гетероатом (кислород, серу, фосфор , азот и т.д.); b – неполярная часть молекулы, обладающая слабым силовым полем, например углеводородная цепь, содержащая алифатические или ароматические группы, или фторуглеродная цепь.

На рис. 1.18 приведена компьютерная модель молекулы ПАВ, представляющая собой наиболее вероятную конформацию С12H25COOH, рассчитанную с учетом длин валентных связей, величин валентных углов и внутримолекулярных взаимодействий. Сравнивая рис. 1.17 и 1.18 можно заключить о полной правомочности использования модели молекул ПАВ Ленгмюра-Гаркинса.
Полярные части молекул ПАВ обладают мощным силовым полем и способны взаимодействовать с молекулами воды, часто с образованием водородных связей, поэтому их называют гидрофильными. Углеводородная цепь (неполярная часть) выталкивается из воды, так как она обладает сродством к неполярной фазе и поэтому называется гидрофобной или олеофильной.
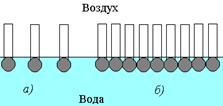
В процессе адсорбции происходит не только накопление вещества в поверхностном слое, но и ориентация молекул — полярная часть направлена в полярную среду, а неполярная — в неполярную. Схема строения адсорбционного слоя приведена на рис. 1.19.
Рис. 1.19. Схема строения адсорбционного слоя молекул ПАВ на поверхности воды:а- ненасыщенный, б- насыщенный адсорбционный слой.
Ленгмюр выдвинул и математически обосновал идею об особом строении адсорбционных слоев. Он рассматривал ненасыщенный слой как двухмерный газ. По мере того как концентрация ПАВ увеличивается происходит процесс, аналогичный конденсации двухмерного газа — молекулы образуют двухмерную пленку, которую Ленгмюр рассматривал как двухмерную жидкость. Если концентрация ПАВ в растворе неограниченно возрастает, то наступает момент предельного насыщения адсорбционного слоя, который приобретает вид частокола, так как предполагается, что слой имеет толщину, соответствующую длине адсорбированной молекулы. При этом адсорбция достигает предела. Эта теория была названа теорией мономолекулярного слоя, или монослоя.
Ленгмюр предполагал, что если при малой концентрации растворенного вещества имеются молекулы, удаленные на большое расстояние друг от друга, то они должны оказывать давление, как и обычные молекулы газа. Они будут стремиться рассеяться по поверхности, удаляясь на еще большие расстояния. В результате теплового движения они обусловят поверхностное давление Ps, действующее противоположно поверхностному натяжению:
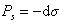
При помощи специально сконструированных поверхностных весов Ленгмюр доказал, что молекулы адсорбционного слоя действительно ведут себя как двухмерный газ.
При очень малой равновесной концентрации ПАВ в растворе, т.е. при 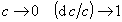

Учитывая, что 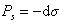
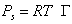
Выражая площадь, занимаемую одним молем адсорбированного вещества (двухмерный газ), через 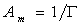
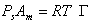
Легко увидеть, что это уравнение подобно уравнению состояния идеальных газов, т.е. уравнению Клапейрона — Менделеева.
Полученное Ленгмюром уравнение (1.1.118) представляет собой уравнение состояния двухмерного газа. Он доказал, что это уравнение справедливо в качестве предельного идеального уравнения состояния поверхностного слоя с адсорбированными молекулами.
Использование рентгеноструктурного и электронографических методов анализа показало, что тонкий слой адсорбционного вещества дает характерную структурную картину жидкого кристалла. Особенно удобен электронографический метод, позволяющий определить площадь, занимаемую одной молекулой ПАВ в адсорбционном слое при насыщении. В то же время эту площадь можно определить на основании данных об адсорбции, так как если насыщение адсорбционного слоя полное, то площадь, занимаемая одной молекулой, становится строго определенной и характерной для данного вида молекул:
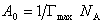
где NA – число Авагадро.
Измерив адсорбцию, можно определить не только площадь поперечного сечения молекул (площадь, занимаемую в насыщенном адсорбционном слое), но и их осевую длину.
Моделируя молекулу ПАВ в виде цилиндра и обозначая осевую длину молекулы h, а площадь поперечного сечения A0, получаем для объема одной молекулы ПАВ V1= A0h. Если взять один моль ПАВ
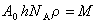
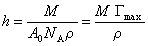
где r – плотность адсорбированного вещества, обычно принимаемая равной плотности ПАВ в конденсированном состоянии.
Установлено, что в гомологическом ряду ПАВ с увеличением длины углеводородного радикала на одну группу -СН2— происходит рост осевой длины молекулы на (1,3¸1,5)10 — 10 м. Следовательно, по измеренной адсорбции можно рассчитать даже длину валентной связи между атомами или размеры каких-либо групп атомов. Наименьшую площадь в насыщенном адсорбционном слое занимает молекула спирта, эта площадь составляет 20,2·10 — 20 м 2 .
Многочисленные исследования подтвердили первоначально сделанное Ленгмюром предположение о мономолекулярности адсорбционного слоя на поверхности водного раствора ПАВ.
Видео:5.2. Молекулярная адсорбция ПАВ на поверхности раздела раствор-воздухСкачать

где Гm (Гmax)– адсорбция в предельно заполненном слое
(Если уравнение Шишковского в форме 
Продифференцировать 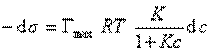
и подставить в уравнение Гиббса величину 
то уравнение изотермы адсорбции примет вид 
В такой форме уравнение изотермы адсорбции носит название изотермы Ленгмюра).
Поверхностная активность, способность вещества при адсорбции на границе раздела фаз понижать поверхностное натяжение (межфазное натяжение). Адсорбция Г в-ва и вызванное ею понижение поверхностного натяжения s связаны с концентрацией с в-ва в фазе, из которой вещество адсорбируется на межфазную поверхность, уравнением Гиббса (1876):
где R — газовая постоянная, Т-абс. температура. Производная 
Поверхностную активность определяют с помощью изотерм адсорбции, на которых можно выделить линейный участок роста Г с увеличением с и предельное значение 

( 
В случае адсорбции вещества из раствора поверхностная активность определяется на основании эмпирич. уравнения Шишковского (1908):
где s0 — поверхностное натяжение чистого растворителя, В -эмпирич. постоянная, практически не зависящая от природы вещества и равная примерно 0,2 при 293 К, 1/А-уд. капиллярная постоянная, характеризующая природу вещества. После дифференцирования уравнение (3) принимает вид:
Уравнение Шишковского позволяет определять поверхностную активность данного вещества более строго, чем уравнение Ленгмюра, из-за отсутствия концентрационных ограничений. Третьим уравнением, используемым для определения поверхностной активности, является уравнение изотермы адсорбции Фрумкина (1949):
Все три уравнения — Ленгмюра, Шишковского и Фрумкина — являются частными случаями уравнения Гиббса (1).
При прочих равных условиях (температура, состав раствора) поверхностная активность вещества зависит в первую очередь от состава и строения молекул.
Наибольшей поверхностной активностью обладают, как показали в 1916-17 И. Ленгмюр и У. Харкинс, вещества, молекулы которых дифильны, т. е. состоят из полярных и неполярных частей. Такие вещества наз. поверхностно-активными веществами (ПАВ). Полярная (гидрофильная) часть молекулы при адсорбции ориентируется в сторону полярной фазы (обычно воды), неполярная часть — углеводородный радикал — выталкивается из полярной фазы, ориентируясь в направлении менее полярной фазы, например воздуха, углеводородных или др. орг. жидкостей. Молекулы ПАВ образуют при адсорбц. насыщении как бы двухмерную (мономолекулярной толщины) кристаллич. решетку. Это дает возможность определять размеры и структуру адсорбирующихся молекул и устанавливать их связь с поверхностной активностью.
Правило Дюкло-Траубе — зависимость, связывающая поверхностную активность водного раствора органического вещества с длиной углеводородного радикала в составе его молекулы. Исследуя поверхностное натяжение водных растворов органических веществ, Траубе и Дюкло установили для гомологических рядов поверхностно-активных веществ следующее эмпирическое правило: В любом гомологическом ряду при малых концентрациях удлинение углеродной цепи на одну группу -СН2— увеличивает поверхностную активность в 3 – 3.5 раза. (Правило было сформулировано И. Траубе в 1891 году в результате его опытов, проведённых на растворах множества веществ (карбоновые кислоты, эфиры, спирты, кетоны) в воде. Предшествующие исследования Э. Дюкло хотя и были близки по духу к работам Траубе, но не предлагали никакой ясной зависимости концентрации, поэтому в зарубежной литературе правило носит лишь имя Траубе. Термодинамическую интерпретацию правила Траубе дал в 1917 году И. Ленгмюр).
Строение адсорбционных слоев на поверхности раздела раствор ПАВ-воздух и определение молекулярных размеров ПАВ.
В 1916–1917 гг. американские ученые Ленгмюр и Гаркинс выдвинули предположение, что молекулы ПАВ имеют дифильное строение, т.е. состоят из двух частей — полярной и неполярной. В дальнейшем это предположение полностью подтвердилось. Эти ученые предложили обозначить молекулу ПАВ, например R-CООH, как приведено на рис. 1, где а – полярная часть молекулы, обеспечивающая ее склонность к гидратации, ассоциации и т.д., например группы -ОН, -NH2, -СООН, кислородсодержащие эфирные группы -ОС2Н4-, группы, содержащие гетероатом (кислород, серу, фосфор ,азот и т.д.); b – неполярная часть молекулы, обладающая слабым силовым полем, например углеводородная цепь, содержащая алифатические или ароматические группы, или фторуглеродная цепь.
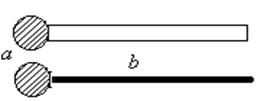 |
| Рис. 1. Схема молекулы ПАВ |
Полярные части молекул ПАВ обладают мощным силовым полем и способны взаимодействовать с молекулами воды, часто с образованием водородных связей, поэтому их называют гидрофильными. Углеводородная цепь (неполярная часть) выталкивается из воды, так как она обладает сродством к неполярной фазе и поэтому называется гидрофобной или олеофильной.
В процессе адсорбции происходит не только накопление вещества в поверхностном слое, но и ориентация молекул — полярная часть направлена в полярную среду, а неполярная — в неполярную. Схема строения адсорбционного слоя приведена на рис. 2.
 Рис. 2. Схема строения адсорбционного слоя молекул ПАВ на поверхности воды: а- ненасыщенный, б- насыщенный адсорбционный слой. Рис. 2. Схема строения адсорбционного слоя молекул ПАВ на поверхности воды: а- ненасыщенный, б- насыщенный адсорбционный слой. |
Использование рентгеноструктурного и электронографических методов анализа показало, что тонкий слой адсорбционного вещества дает характерную структурную картину жидкого кристалла. Особенно удобен электронографический метод, позволяющий определить площадь, занимаемую одной молекулой ПАВ в адсорбционном слое при насыщении. В то же время эту площадь можно определить на основании данных адсорбции, так как если насыщение адсорбционного слоя полное, то площадь, занимаемая одной молекулой, становится строго определенной и характерной для данного вида молекул: 
Измерив адсорбцию, можно определить не только площадь поперечного сечения молекул (площадь, занимаемую в насыщенном адсорбционном слое), но и их осевую длину. Моделируя молекулу ПАВ в виде цилиндра и обозначая осевую длину молекулы h, а площадь поперечного сечения A0, получаем для объема одной молекулы ПАВ V1= A0h. Если взять один моль ПАВ 

Процесс мицеллообразования обычно рассматривают с двух позиций: либо как процесс, подчиняющийся закону действующих масс, либо как фазовое разделение. При рассмотрении мицеллообразования подобно процессу, описываемому законом действующих масс, т.е. аналогично химической реакции, в которой мономерные молекулы соединяются с образованием некоторого подобия полимера этот процесс описывают уравнением 
Закон действующих масс предполагает равновесие между молекулами ПАВ в растворе и в мицеллах. При этом предполагается, что все мицеллы идентичны, т.е. содержат вполне определенное постоянное число молекул независимо от концентрации растворов и температуры.
Другая распространенная точка зрения на мицеллообразование как на фазовое разделение рассматривает образование мицелл подобно конденсации, а мицеллы рассматривают как новую фазу. Считается, что мицеллообразование происходит лишь при достижении концентрации насыщения молекулярного раствора.
Оба эти подхода имеют как достоинства, так и недостатки. Например, при рассмотрении мицеллообразования с позиций фазового превращения мицеллообразование более просто описывается теоретически и для термодинамических расчетов появляется возможность использовать простые уравнения.
Строение и свойства мицелл ПАВобусловлены межмолекулярными взаимодействиями между компонентами системы. В случае водных р-ров ионогенных ПАВ устойчивость мицелл определяется равенством сил притяжения неполярных (углеводородных) частей молекул и отталкиванием полярных (ионогенных) групп. Силы притяжения углеводородных частей молекул ПАВ в воде можно отождествить с гидрофобными взаимодействиями, к-рые обусловливают кооперативность мицеллообразования; отталкивание полярных групп приводит к ограничению роста мицелл. Могут быть и др. причины, приводящие к ограничению роста мицелл, такие, как геометрия молекул ПАВ, зависимость поверхностного натяжения на границе раздела мицелла-растворитель от радиуса мицеллы. В неводных полярных средах (этиленгликоль, глицерин и др.) при мицеллообразовании возникают лиофобные взаи-мод. между углеводородными частями молекул ПАВ, аналогичные гидрофобным.
Большинство эксперим. данных свидетельствует о том, что в водных р-рах мицеллы представляют собой идеально сферич. частицы как в случае катион- и анионактивных, так и неионогенных ПАВ (рис. 2). Гидрофобные части дифильных молекул ПАВ образуют внутр. область (ядро)мицеллы, полярные концы молекул образуют поверхностный слой и всегда гидратированы, т.е. связаны с одной или неск. молекулами воды. Упорядоченность ядра мицеллы является промежуточной между жидким и кристаллич. состояниями непредельных углеводородов (алканов
Рис. 2. Схематическое изображение ассоциатов ПАВ в воде: а — сферич. прямая мицелла; б- обращенная мицелла.
Солюбилизация – это растворение под действием ПАВ нерастворимых в данной жидкости веществ. Процесс солюбилизации можно рассматривать как распределение труднорастворимого вещества между истинным раствором и мицеллами ПАВ. Очевидно, что абсолютно нерастворимые вещества не будут и солюбилизироваться, так как их переход от частиц или капель в мицеллы должен происходить через молекулярный раствор. Для водных растворов характерна солюбилизация маслоподобных гидрофобных веществ – углеводородов, дисперсных красителей и др. веществ, которые хорошо растворяются в углеводородных жидкостях и трудно растворяются в воде. Для растворов ПАВ в неполярных растворителях характерна солюбилизация воды и водных растворов различных веществ.
Подобные коллоидные растворы аналогичны высокодисперсным эмульсиям прямого (м/в – «масло в воде») и обратного (в/м – «вода в масле») типов. Однако, в отличие от эмульсий, которые представляют собой грубодисперсные системы с четко выраженной поверхностью раздела фаз, обладают избыточной поверхностной свободной энергией и требуют для своего получения затраты работы, мицеллярные растворы ПАВ с солюбилизированным веществом обладают термодинамической устойчивостью, хотя и являются двухфазными системами. Насыщенный солюбилизатом M. p. иногда называют микроэмульсией.
Mицеллярные растворы применяют в технологии полимеров, при обогащении природных ископаемых, изготовлении смазочно-охлаждающих жидкостей и др. B нефтедобывающей промышленности мицеллярные растворы (гл. обр. на основе нефт. сульфонатов) используют при заводнении продуктивных пластов для повышения их нефтеотдачи. Нагнетаемый в пласт мицеллярных растворов улучшает избирательное смачивание нефтесодержащей породы водой, способствуя вытеснению остаточной нефти.
🎦 Видео
Поверхностно-активные вещества LINDERAСкачать

5.3. Адсорбция на границе жидкость-газ. Поверхностно активные вещества ПАВСкачать

5.1. Адсорбция. Классификация адсорбцииСкачать

8.1 Поверхностно-активные вещества | Химия вокруг насСкачать

Динамика молекул ПАВ в мезоструктурированных материалахСкачать

Матвеенко В. Н. - Коллоидная химия - Поверхностно-активные веществаСкачать

Адсорбция на поверхностях растворовСкачать

Виды и схемы работы ПАВСкачать

Коллоидные растворы ПАВ (мицеллярные растворы, лиофильнные растворы) | Коллоидная химия | Лекция 5Скачать

5.4. Мицеллообразование в растворах ПАВ. Критическая концентрация мицелообразованияСкачать

Поверхностно Активные ВеществаСкачать

Поверхностные явления. Адсорбция на подвижных границах раздела фаз.Скачать

Урок 197. Поверхностная энергия. Коэффициент поверхностного натяженияСкачать

Схема адсорбции молекул на границе раздела фаз «жидкость—твердое тело»Скачать

Как отличать полярные молекулы от неполярных? Дипольный момент.Скачать

Технология Evotherm часть 2 - Химия поверхностно-активных веществСкачать

Поверхностные явления. Адсорбция.Скачать