Молекулярная специфика в перехватах Ранвье
| Эволюционная необходимость быстрой и эффективной проводимости потенциалов действия в нейронах позвоночных привела к образованию миелиновой оболочки. Миелин – многослойная оболочка, сформированная в центральной нервной системе олигодендроцитами, а в периферической нервной системе Шванновскими клетками – обертывает сегменты аксона, разделенные узловыми перехватами Ранвье (РИС.1а). Миелиновая оболочка ослабляет прохождение current flow через мембрану аксона посредством снижения ее емкости (capacitance) и увеличения ее transverse resistance, давая, таким образом, возможность быстрому сальтаторному продвижению нервного импульса от перехвата к перехвату. В результате большое число аксонов с высокой скоростью проводимости может быть заключено в ограниченное пространство. И этот признак дает возможность для развития более сложной нервной системы. Кроме того, сальтаторная проводимость устраняет необходимость восстановления потенциала действия в каждой точке мембраны аксона. Следовательно, снижаются метаболические требования для активности нейронов. |
Organization and function of the nodal environs
Скоординированная дифференцировка аксона и его миелинизирующих клеток требует тесной взаимосвязи между нейронами и глией на самых ранних стадиях развития. Сигналы, передаваемые аксоном, регулируют пролиферацию, выживаемость и дифференцировку олигодендроцитов и Шванновских клеток и участвуют в детерминации толщины миелина. Реципрокные глиальные сигналы влияют на цитоскелет аксонов и аксонный транспорт и необходимы для выживаемости аксонов. В результате таких реципрокных связей миелинизированные волокна приобретают структурные признаки, позволяющие им максимизировать скорость проведения импульса. Одним из таких признаков является разделение мембраны аксона на отдельные молекулярные, структурные и функциональные домены. Такие домены включают перехваты Ранвье, paranodal junction (околоузловое соединение), juxtaparanodes (участок, расположенный за paranodal junction ) и internodal (межперехватный участок (РИС.1b и 2). Авторы сфокусировали внимание на молекулярных механизмах, лежащих в основе образования и поддержания этих уникальных доменов аксона, необходимых для нормального функционирования нервной системы.
The node of Ranvier
Узловые перехваты Ранвье представляют собой небольшие по длине, равномерно расположенные разрывы миелиновой оболочки. Интервал между перехватами Ранвье имеет длину примерно в 100 раз большую диаметра нервного волокна. Имеются некоторые различия в структурных характеристиках перехватов между центральной и периферической нервными системами. В периферических нервах весь миелинизированный участок аксона покрыт базальной оболочкой (базальным слоем) (basal lamina), а внешний слой (outer collar) шванновской клетки имеет микроворсинки, покрывающие узловые перехваты (РИС. 1b). Околоузловое пространство (т.е. пространство между аксолеммой и базальным слоем), содержащее микроворсинки, также заполнено волокнистым матриксом. В ЦНС нет basal lamina и контакт перехватов осуществляется через околоузловые астроциты (perinodal astrocyte=перинодальные астроциты), которые недавно были названы синантоцитами (synantocytes) [Butt, A. M., Kiff, J., Hubbard, P. & Berry, M. Synantocytes: new functions for novel NG2 expressing glia. J. Neurocytol. 31, 551-565. 2002].
The nodal axolemma. Перехваты Ранвье характеризуются высокой плотностью (>1200/ μm2) Na+ каналов, которые важны для образования потенциала действия во время сальтаторной проводимости. Voltage-gated Na+ каналы представляют собой мультимерные комплексы, состоящие из пора-формирующей (pore-forming) α субъединицы и одной или более вспомогательных βсубъединиц (РИС.2а). У млекопитающих αсубъединицы кодируются девятью генами α-(Scn1a–Scn9a, β – четырьмя генами для β -субъединиц (Scn1b–Scn4b). Перехваты Pанвье в ЦНС и периферической нервной системе (ПНС) содержат в основном Nav1.6. Кроме того, во многих перехватах Ранвье ЦНС найдены Nav1.2 и Nav1.8, тогда как Nav1.9 обнаружены лишь в некоторых узловых перехватах ПНС. Во время развития и ЦНС, и ПНС экспрессируются Nav1.2, которые позже замещаются на Nav1.6. Функциональное значение такого переключения пока неясно, но это, вероятно, позволяет нейронам адаптироваться к высоко-частотному firing. Кроме voltage-gated Na+ каналов в узловых перехватах было идентифицировано несколько других трансмембранных и цитоскелетных белков – молекулы клеточной адгезии (cell-adhesion molecules – CAMs) иммуноглобулинового (Ig) суперсемейства Nrcam и neurofascin-186 (Nf186), цитоскелетный адаптер ankyrin G и актин-связывающий белок spectrin βIV (Berghs, S. et al. βIV spectrin, a new spectrin localized at axon initial segments and nodes of ranvier in the central and peripheral nervous system. J. Cell Biol. 151, 985-1002. 2000). Недавно было обнаружено присутствие двух К+ каналов в узловых перехватах Ранвье – Kv3.1 и Kcnq2 (Devaux, J. et al. Kv3.1b is a novel component of CNS nodes.J. Neurosci 23, 4509-4518 (2003). Devaux, J. J., Kleopa, K. A., Cooper, E. C., Bennett, V. & Scherer, S. S. Anatomical and physiological evidence of KCNQ2 subunits at PNS and CNS nodes. Soc. Neurosci Abstr. 28, 368.8. 2003). Kv3.1 обнаружен в основном в перехватах крупных аксонов ЦНС и в небольшом числе перехватов ПНС. Kcnq2 локализован во всей ПНС и в большинстве узловых перехватов ЦНС.
Na+ channel β-subunits and CAMs Показано, что β -субъединицы Na+ каналов модулируют channel gating («затворы» каналов) для облегчения доставки Na+ каналов к клеточной поверхности и для их работы в качестве CAMs. Внеклеточный домен этих β-субъединиц имеет единственный Ig домен, который опосредует homophilic взаимодействие, а также связывание с другими компонентами узлового перехвата. β1- и β3-субъединицы взаимодействуют в cis с Nf 186, β1 связывает также contactin – glycosylphosphatidylinositol (GPI) anchored glycoprotein, обнаруженный во всех paranodes (см. ниже) и перехватах в ЦНС. Взаимодействие с contactin усиливает экспрессию Na+ каналов на поверхности трансфицированных клеток, указывая на то, что эта CAM важна для экспрессии Na+ каналов в перехватах Ранвье. В соответствии с данной гипотезой, экспрессия этих каналов заметно снижена в зрительном нерве contactin-null мышей. β1- и β2-субъединицы также взаимодействуют с молекулами внеклеточного матрикса tenascin-C и tenascin-R, также как и с phosphacan, – секретируемой формой рецепторного белка тирозин фосфатазы β (receptor protein tyrosine phosphatase β (Rptp β).
Cytoskeletal proteins.Перехваты и начальный сегмент аксона обогащены ankyrin G – мембранно-цитоскелетным адаптером, связывающим интегральные мембранные белки с spectrin cytoskeleton. Ankyrin G взаимодействует с Na+ каналами – с их α- и β-субъединицами, а также с Nf 186, Nrcam и Kv3.1. β-субъединица «вербует» ankyrin G для плазменной мембраны и такое взаимодействие регулируется tyrosine phosphorylation. Связывание ankyrin G с α-субъединицей осуществляется через последовательность девяти аминокислот, присутствующих во всех известных voltage-gated Na+ каналах. Такой девяти-аминокислотный лейтмотив необходим для аккумуляции α-субъединицы в начальном сегменте аксона. Более того, такой ankyrin-binding сайт локализован в пределах короткой последовательности, которой достаточно, чтобы таргетировать белки для начального сегмента аксона. Остается определить, нужна ли эта короткая последовательность для таргетирования перехватов Ранвье. Связывание ankyrin G с двумя перехватными Ig-CAMs, Nf186 и Nrcam опосредуется группой из двенадцати аминокислот, найденной в их цитоплазматических доменах. Ankyrin G связывается с этими группами только тогда, когда он дефосфорилирован, указывая на то, что неидентифицируемые тирозин киназы и фосфатазы могут регулировать такое взаимодействие. Tyrosine-phosphorylated neurofascin локализован в глиальных параузлах (paranodes), а не в перехватах, свидетельствуя в пользу гипотезы, согласно которой перехватный neurofascin тесно связан с ankyrin G. Ankyrin G также связывает spectrin βIV – spectrin изоформу, присутствующую в изобилии в перехватах Ранвье и начальных сегментах аксонов – связывая в дальнейшем узловые Na + каналы и Ig-CAMs с цитоскелетом аксона.
The nodal gap, extracellular matrix and the glial membrane В ПНС узловой пробел (перехват) заполнен микроворсинками Шванновских клеток, происходящими из наружной оболочки клетки (РИС.1b). В проксимальной области микроворсинок мембраны двух соседних Шванновских клеток соединены tight junctions (плотным соединением), но эти соединения не изолируют узелковый пробел. Было обнаружено, что они проницаемы для пероксидазы хрена, прикладываемой снаружи нервного волокна. Три белка – erzin, radixin и moesin, так же как и erzin-связывающий белок EBP50 и Rho-AGTPasa локализованы в микроворсинках. Потенциально эти белки могут связывать актин-обогащенные микроворсинки с интегральными мембранными белками (integral membrane proteins). Кроме того, несколько белков внеклеточного матрикса (extracellular matrix (ECM) proteins) найдено в узловых пробелах под базальной оболочкой, включая hyaluronan-binding proteoglycan versican, tenascin-C и NG2 proteoglycan. Недавно было показано, что dystroglycan в избытке экспрессирующийся на abaxonal поверхности миелинизирующих Шванновских клеток также локализуется в перехватах. Специфическое удаление dystroglycan в Шванновских клетках приводит к дезорганизации микроворсинок, заметной редукции узловых Na+ каналов и к последующему нарушению проводимости нервного волокна.
В отличие от ПНС, в ЦНС отростки перинодальных астроцитов (perinodal astrocytes) (РИС.1b) контактируют с большинством узловых перехватов. Было показано, что узловой пробел в ЦНС включает несколько протеогликанов, в том числе tenascin и phosphacan. Узловые пробелы ЦНС также содержат versican-binding protein Bral1, продуцируемый нейронами. Функции этих белков пока неясны, однако предполагают, что благодаря высокому содержанию в них acidic disaccharides, они могут обеспечивать негативную среду, служащую в качестве внеклеточного резервуара Na+ в перинодальном пространстве. И tenascin-C, и tenascin-R связываются с Na+ каналами и изменяют их электрофизиологические свойства. Генетическое удаление tenascin-R ведет к снижению нервной проводимости, но не оказывает никакого эффекта на распределение Na+ каналов в узловых перехватах, указывая на то, что такое взаимодействие может стабилизировать узловые комплексы или регулировать активность каналов, но не требуется для первичной кластеризации этих каналов. Сообщалось также, что Na+ каналы связывают цитоплазматический конец (tail) и внеклеточный домен Rptpβ – рецепторную тирозин фосфатазу, о локализации которой в узловой аксолемме (nodal axolemma) пока не сообщалось. Более того, значимость этих взаимодействий для нормальной физиологии миелинизированных нервов пока неясна, т.к. распределение узловых Na+ каналов и скорость проводимости миелинизированных аксонов в ЦНС нормальны у Rptpβ-дефицитных мышей. Стоит отметить, что и tenascin-R, и Rptpβ также взаимодействуют с contactin и Nrcam, присутствующими в узловых перехватах ЦНС, указывая на возможное присутствие крупных макромолекулярных комплексов в перинодальном пространстве.
The axoglial paranodal junction
Morphology and molecular composition. C обеих сторон перехватов Ранвье компактная миелиновая оболочка раскрывается и формирует заполненные цитоплазмой глиальные петли (glial loops), которые спирально наматываются вокруг аксона (РИС.1b). Такие паранодальные петли соединены с аксолеммой серией перемычек (поперечных полосок – transverse bands), которые напоминают septate junctions (перегородчатые соединения) у беспозвоночных (BOX1). Аксоглиальные соединения появляются относительно поздно во время миелинизации – сначала они образуются ближе к перехватам наиболее отдаленной паранодальной петлей и постепенно распространяются по мере того, как дополнительные петли прикрепляются к аксону. В итоге, они состоят из множества колец, каждое из которых представляет собой виток миелиновой оболочки.
Мембрана аксона в месте аксоглиального соединения содержит комплекс из двух cell-recognition молекул — contactin-associated protein (Caspr, также известные как paranodin) и contactin (РИС.2b). Caspr является трансмембранным белком типа I, принадлежащим к отдельной подгруппе neurexins – полиморфного белкового семейства, участвующего в клеточной адгезии и межклеточных связях. У человека известно 5 генов семейства Caspr – CASPR1–CASPR5 (Spiegel, I., Salomon, D., Erne,et. al. Caspr3 and caspr4, two novel members of the caspr family are expressed in the nervous system and interact with PDZ domains. Mol. Cell. Neurosci. 20, 283-297. 2002). У дрозофилы известно 2 гена – nrxIV и axo и у Caenorhabditis elegans также 2 гена – itx-1 и nlr-1 [L. Haklai-Topper and E.P., unpublished observations]. Эти белки связывают некоторые CAMs и, следовательно, могут рассматриваться как CAM-ассоциированные белки. Их внеклеточная область состоит из нескольких доменов, участвующих в межбелковых взаимодействиях, включая discoidin и fibrinogen-like domain, epidermal growth factor (EGF) motifs, и несколько областей гомологичных G домену laminin A (BOX 1). Caspr, но не другие члены семейства Caspr, формирует комплекс с contactin только в cis. Взаимодействие между Caspr и contactin необходимо для эффективного экспорта Caspr из эндоплазматического ретикулума к плазменной мембране, оно регулирует glycosylation и транспорт contactin. Caspr и contactin связаны в эндоплазматическом ретикулуме и могут быть транспортированы через Гольджи-независимый путь (Golgi-independent pathway) к клеточной поверхности. Так же как и при исследовании in vitro, у contactin-дефицитных мышей Caspr сохраняется в теле нейрона и не достигает аксона (Boyle, M. E. et al.2001), но Caspr необходим для поддержания contactin в paranodes (Gollan, L. et al. Retention of a cell adhesion complex at the paranodal junction requires the cytoplasmic region of Caspr. J. Cell Biol. 157, 1247-1256 (2002). Shows that the stabilization of the Caspr/contactin complex at the cell membrane requires the intracellular region, which includes the protein 4.1B-binding domain).
И Caspr, и contactin важны для образования axoglial junction (аксоно-глиального соединения) и их отсутствие ведет к исчезновению септ (перемычек) и расширению пространства между аксоном и паранодальными петлями. Результаты указывают, что Caspr и contactin могут быть частью paranodal adhesion complex, который необходим для плотного соединения двух оболочек. Фенотип contactin-дефицитных мышей сходен с фенотипами двух других паранодальных мутантов – galactolipids-дефицитными мышами, у которых отсутствует UDP-galactose ceramide galactosyltransferase (Cgt) и не синтезируются galactocerebroside (GalC) и sulfatide и cerebroside sulfotransferase ( Cst)-null мышами, у которых отсутствует синтез только sulfatide. У всех этих мутантов Caspr и contactin отсутствуют в paranodes. Путь, при котором отсутствие GalC и sulfatide вызывает паранодальные аномалии, неясен, но можно предположить, что это результат прямого связывания sulfatide с Caspr/contactin комплексом. И, напротив, говоря о роли galactolipids в формировании LIPLD RAFTS (липидных плотиков) и организации миелина, можно предположить, что их отсутствие может привести к превращению junctional glial компонентов в не-компактный миелин. Последнее предположение подтверждается недавними находками, показавшими, что генетическое удаление миелинового и лимфоцитарного (myelin and lymphocyte – MAL) белка, – raft-ассоциированной молекулы, участвующей во внутриклеточном трафике, – ведет к паранодальным аномалиям (N. Schaeren-Wiemers and U. Suter, personal communication).
Внутриклеточные области Caspr и Caspr2 содержат juxtamembrane последовательность, которая связывает protein 4.1B, присутствующий в paranodes и juxtaparanodes. Как и другие 4.1 белки, 4.1В белок содержит консервативный actin–spectrin-binding домен и, следовательно, может связывать Caspr (и следовательно contactin) с цитоскелетом. В соответствии с этой гипотезой, protein 4.1B аномально распределяется вдоль периферических миелинизорованных аксонов у мышей с отсутствием либо contactin, либо galactolipids, у которых отсутствуют паранодальные Caspr. У этих мутантов местоположение белка 4.1В коррелирует с положением Caspr и Caspr2, указывая на то, что они могут определять его локализацию. Более того, цитоплазматический конец Caspr нужен для стабилизации Caspr/contactin комплекса в paranodes, т.к. у Caspr мутантов с отсутствием этого домена не сохраняется axoglial junction. Поэтому, вероятно, что Caspr является трансмембранным скаффолдом, который стабилизирует Caspr/contactin adhesion complex в septate-подобных соединениях связывая комплекс с аксонным цитоскелетом через белок 4.1В. Этот механизм напоминает функцию neurexin IV Drosophila, который захватывает Coracle (гомолог белка 4.1) для septate junctions (BOX 1). Кроме того, цитоплазматический Caspr также связывает FERM domain (four-point-one, ezrin–radixin–moesin)-содержащий белок Schwanomin/merlin. Однако значение такого взаимодействия не совсем ясно, поскольку Schwanomin не концентрируется в области паранодального соединения.
Распределение Caspr и contactin вдоль internodes (межперехватов) (см. далее в тексте), их накопление в paranodes (как число колец, представляющих витки миелиновой обертки во время развития), аномальное распределение Caspr при рассеянном склерозе и у некоторых «миелиновых» мутантов указывают на то, что миелиновая оболочка определяет локализацию Caspr и contactin в аксолемме. Более того, добавление растворимого Rptpβ, связывающего contactin с myelinating co-cultures, нарушает паранодальное накопление Caspr, указывая на то, что локализация Caspr/contactin complex в этом участке может быть опосредована его взаимодействием с глиальным лигандом. Наиболее подходящим кандидатом глиального лиганда для Caspr/contactin complex является Nf155 – глиальная изоформа CAM neurofascin, который локализован вместе с Caspr и contactin в месте аксоглиального соединения (axoglial junction) и не локализуется в этом участке в отсутствии Caspr. В подтверждение этой гипотезы недавно появилось сообщение, что soluble Nf155-Fc chimaera связывается с клетками, экспрессирующими Caspr и contactin, а преципитация этих белков из лизатов мозга крыс указывает на то, что Nf155 может служить в качестве рецептора для Caspr/contactin complex. Однако последние сообщения подвергли сомнению данную модель, так как было показано, что когда Nf155 связывается непосредственно с contactin, то Caspr подавляет такое взаимодействие. Это указывает на возможное существование других рецепторов для Caspr/contactin complex в миелинизирующей глии. Это наблюдение согласуется с предыдущими сообщениями, показавшими, что Nf155 в paranodes появляется намного позже, чем Caspr.
Function of the paranodal junction. Предполагают, что paranodal junction присоединяет миелиновую оболочку к аксону, чтобы отделить электрическую активность в перехватах Ранвье от межперехватного участка (internodal region), находящегося под компактной миелиновой оболочкой, и служит в качестве преграды (fence), которая ограничивает латеральную диффузию белков аксолеммы. Недавние исследования с использованием 4-х паранодальных мутантных мышей – мышей с отсутствием Caspr, contactin, Cgt и Cst, (все с отсутствием характерной перегородки (septa) в аксоглиальном соединении) – позволили прекратить проверку этих оригинальных идей. В ЦНС этих мутантов паранодальные петли (paranodal loops) дезорганизованы, имеется множество перекрывающихся и инвертированных петель, обращенных в сторону от аксона. В ПНС этих мутантов морфологические изменения менее выражены, возможно, благодаря присутствию базального слоя (basal lamina). Параузлы (paranodes) хорошо организованы, однако увеличено пространство между глиальной оболочкой и аксоном. Но даже в отсутствие перегородки (septa) паранональные петли (loops) все еще тесно прикреплены к аксону во многих участках ЦНС и ПНС, указывая на присутствие до сих пор не идентифицированных паранодальных компонентов, которые опосредуют аксо-глиальный контакт в этом участке. Вместе с электронно-микроскопическими данными, показавшими, что поперечные соединения (transverse bands) образуются позже во время миелинизации, эти исследования указывают на возможную роль перегородки (septa) в сохранении паранодальных петель (колец) для аксона в аксоглиальном соединении. В соответствии с этими наблюдениями, постепенное, зависимое от возраста открепление паранодальных колец от аксона наблюдали в ЦНС Caspr-null мышей (Rios, J. C. et al. Paranodal interactions regulate expression of sodium channel subtypes and provide a diffusion barrier for the node of Ranvier. J. Neurosci. 23, 7001-7011. 2003).
Отсутствие паранодальной перегородки (paranodal septa) у четырех паранодальных мутантов ведет к реорганизации мембраны аксона (РИС.3). У этих мутантов shaker-type К+ каналы, в норме присутствующие в juxtaparanodal области неправильно локализованы по отношению к паранодальной мембране аксона. Поэтому, возможно, что паранодальное перегородчатое соединение (paranodal septate junction) функционирует как барьер, который ограничивает передвижение К+ каналов из-под компактного миелина, отделяя их от Na+ каналов в узловых перехватах. В противоположность juxtaparanodal К+ каналам, нарушение паранодальной перегородки минимально влияет на распределение узловых Na+ каналов. Существует небольшое увеличение длины перехватов, сопровождаемое уменьшением мембранных частиц (particles) в узловой аксолемме, определяемое при FREEZE –FRACTURE электронной микроскопии. Это указывает на то, что paranodal septate junction не является необходимым для появления перехватов. Однако глиальное прикрепление в области paranodes в ЦНС необходимо для сохранения Na+ кластеризации в аксолемме.перехвата Ранвье
Juxtaparanode локализуется в короткой области сразу за paranodal junction (РИС.1b). При freeze-fracture электронной микроскопии эта область представляет собой нерегулярно расположенные частицы, которые в большей степени сконцентрированы вблизи paranodes и более диффузны по мере приближения к межперехватам (internodes). Эти частицы соответствуют скорее всего гетеромультимерам delayed rectifier K+ каналов семейства Shaker – Kv1.1, Kv1.2 и Kvβ2. В juxtaparanodal аксолемме эти каналы колокализуются и образуют комплекс с Caspr2, вторым членом Caspr семейства. Кроме того, в этом участке присутствует Kv1.6, преимущественно в небольших аксонах. Два других белка, обнаруженных в juxtaparanodes, представляют собой транзиторный аксональный glycoprotein-1 (Tag1) – GPI-связанный CAM, родственный contactin, и connexin 29 (Cx29), обнаруженый в глиальной мембране. Связь Caspr2 с К+ каналами опосредуется их карбокси-терминальной областью, вероятнее всего через неидентифицируемый PDZ DOMAIN-содержащий белок. И хотя один такой белок Psd95 локализован в juxtaparanodes и ассоциируется с К+ каналами, он, как оказалось, не участвует во взаимодействии этих каналов с Caspr2 или их накоплении в этой области. Два последних исследования показали, что Caspr2 и Tag1 формируют juxtaparanodal complex, состоящий из глиальной Tag1 молекулы и аксонального Caspr2/Tag1 гетеродимера (РИС.2с) [Poliak, S. et al. Juxtaparanodal clustering of Shaker-like K+ channels in myelinated axons depends on Caspr2 and TAG-1. J. Cell Biol. 162, 1149-1160 (2003)]. Этот комплекс необходим для аккумуляции К+ каналов в juxtaparanodes, поскольку прицельное нарушение Caspr2 или Tag1 приводит к значительному снижению juxtaparanodal аккумуляции этих каналов в аксонах как ЦНС, так и ПНС (РИС.3). Эти результаты указывают, что Caspr2 и Tag1 могут формировать скаффолды, способные позиционировать ионные каналы в специфических участках плазменной мембраны, и это напоминает механизм, работающий во время формирования синапсов.
Role of K+ channels under the myelin sheath. Предполагали, что juxtaparanodal К+ каналы работают как активные «заслонки» (damper) для возвратного возбуждения (re-entrant excitation) и способствуют сохранению межперехватного потенциала покоя (internodal resting potential). И хотя теоретически этих каналов, разбросанных в межперехватах, достаточно для поддержания потенциала покоя, для предупреждения re-entrant excitation требуется повышенная пространственная кластеризация К+ каналов около перехвата. Несмотря на значительное устранение в juxtaparanodal кластере Kv1.1/Kv1.2 у Caspr2- и Tag1-нокаутных мышей, никаких изменений в возбудимости миелинизированных нервов у них не выявлено. То, что общее количество этих каналов остается постоянным у обоих мутантов может указывать на то, что главная роль этих покрытых миелином К+ каналов заключается в поддержании межперехватного потенциала покоя. Кроме того, компьютерное моделирование, при котором учитывались вариации распределения К+ каналов и проводимости аксоглиального соединения (axoglial junctional conductance) показало, что кластеризация К+ каналов в juxtaparanode может обеспечивать защитную функцию в аксонах, которые могут подвергаться слабой демиелинизации (РИС.4). В соответствии с этой моделью Caspr2 иTag1 могут обеспечивать стабильность в аксонах, аксоглиальные соединения которых подвержены определенному риску.
Другой функцией juxtaparanodal К+ каналов может быть их посредническая роль в аксоглиальном процессе передачи информации. В ПНС эти каналы локализованы across from Cx29 гемиканалов (hemichannels), которые присутствуют в adaxonal мембране миелинизирующих Шванновских клеток и наиболее вероятно соответствуют розеточным частицам, видимым при freeze-fracture электронной микроскопии в этом участке. Такие гемиканалы могут обеспечивать прямой путь для ионов К+ из аксона в глию. Это, в свою очередь, могло бы генерировать зависимый от активности сигнал в Шванновскую клетку, что напоминает электрические синапсы сформированные gap junctions. В поддержку этой гипотезы предположили, что Ca2+ transients, записываемые в Шванновских клетках до электрической стимуляции аксона, генерировались К+ efflux (утечкой) из аксона, что деполяризует глиальную мембрану. Обмен информацией через такой «аксоглиальный синапс» в juxtaparanodes может обеспечивать дополнительный механизм для axon–gliacommunication. Интересно то, что паранодальное аксоглиальное соединение (paranodal axoglial junction) также может быть ремоделировано активностью нейронов. Этот эффект может быть отчасти опосредован контролем экспрессии contactin на поверхности аксона.
Хотя никакой специфики соединений не наблюдали между глией и аксоном в области межперехватов, при freeze-fracture электронной микроскопии было обнаружено, что межперехватная аксолемма в ПНС содержит продольные нити (longitudinal strands) внутримембранных частиц, напоминающих нити, найденные в paranodes и в juxtaparanodal областях. Как показано на РИС. 1с и 1d, Caspr и contactin локализуются по всей межперехватной области в полосе, фланкированной К+ каналами и Caspr2, которая соединяет внутренний мезаксон (inner mesaxon) миелиновой оболочки и формирует периферическое кольцо ниже внутренней стороны SCHMIDT-LANTERMAN INCISURES. Эта линия, названная juxtamesaxonal и juxta-incisural (Scherer, S. S. & Arroyo, E. J. Recent progress on the molecular organization of myelinated axons. J. Peripher. Nerv. Syst. 7, 1-12. 2002), является прямым продолжением paranodes/juxtaparanodes. Следовательно, Nf155, Cx29 и Tag1 ограничены в дополнительном распространении на adaxonal мембране миелинизирующих Шванновских клеток. Эти находки указывают, что локализация аксонных белков в межперехватах диктуется миелиновой оболочкой, вероятно, посредством механизма, сходного с тем, который работает в paranode/juxtaparanode. Однако недавний анализ Caspr2-null мышей показал, что разные механизмы могут контролировать локализацию К+ каналов в juxtaparanodes и в juxtamesaxon. Молекулярная организация межперехватной области не изучена в миелинизированных нервах ЦНС.
Formation of the nodal environ
The role of myelinating glia. Во время развития миелинизации нервов в ПНС разные узловые домены формируются постепенно. Na+ каналы сначала кластеризуются в перехватах, затем появляется паранодальное соединение и позже происходит группировка К+ каналов в области juxtaparanode. И в ЦНС, и в ПНС Na+ каналы кластеризуются сначала в участках, прилегающих к границам отростков олигодендроцитов и миелинизирующих Шванновских клеток. Дальнейший продольный рост этих отростков вызывает смещение кластеров до тех пор, пока два соседних кластера не сольются, формируя новый перехват Ранвье. Эти результаты свидетельствуют о том, что Na+ кластеры позиционируются посредством прямого глиального контакта. Следовательно, распространение Na+ каналов является диффузным в ретинальных ганглиозных клетках (retinal ganglion cells), но они правильно кластеризуются в перехватах, после того как аксоны пересекут lamina cribrosa и станут миелинизированными. Эти каналы не группируются после удаления олигодендроцитов или Шванновских клеток и рассеиваются во время демиелинизации. Более того, перехватные Na+ каналы связаны с краями миелинизирующих Шванновских клеток в нервах с более короткими межперехватами, что является результатом ремиелинизации (remyelination) или генетической мутации, как, например, у мутантных мышей CLAW PAW. Однако исследование с использованием ганглиозных клеток ретины показало, что Na+ кластеризация может быть индуцирована in vitro растворимыми факторами, секретируемыми культивируемыми олигодендроцитами. И хотя Шванновские клетки не проявляют такой кластеризирующей активности, некоторая кластеризация Na+ каналов определялась в отсутствии миелинизирующих Шванновских клеток у дистрофичных мышей. Недавний анализ dysmyelinating или paranodal мутантов, а также моделей демиелинизации показал, что присутствие интактных миелинизирующих олигодендроцитов необходимо для включения во время развития изоформы Na+ канала в перехватах. И, напротив, Nav1.6 обнаружена в перехватах у двух миелиновых мутаций, которые ассоциируются с гибелью олигодендроцитов и отсутствием нормального паранодального соединения. – у MYELIN DEFICIENT (MD) крыс и у JIMPY мутантных мышей. Эти наблюдения указывают, что «включение» может происходить в отсутствие нормального паранодального контакта или миелина. Следует отметить, что недавний анализ SHIVERER мутантов показал, что в то время как аксоглиальный контакт необходим для экспрессии Nav1.6 в перехватах, он не нужен для таргетирования этой подгруппы в начальном сегменте аксона, что свидетельствует о существовании множественных адресных механизмов при миелинизации аксонов.
Molecular assembly. Во время миелинизации нервов в ПНС, Nrcam и Nf186 первыми определяются в перехватах, после чего появляются ankyrin G и Na+ каналы. Однако в ЦНС ankyrin G определяется в перехватах до кластеризации Nf186 и Na+ каналов. Эти результаты указывают, что Nrcam, Nf186 или неидентифицируемый ankyrin G-binding белок связывают ankyrin G, который, в свою очередь, «рекрутирует» Na+ каналы. В поддержку этой модели свидетельствует тот факт, что добавление растворимого Nrcam в культуру myelinating dorsal root ganglia подавляет кластеризацию Na+ каналов. Более того, появление ankyrin G и Na+ каналов в перехватах отсрочено у Nrcam-null мышей, что свидетельствует об участии этой адгезивной молекулы в кластеризации. Формирование перехватов у этих животных можно объяснить присутствием Nf186, который содержит сходный ankyrin G-binding сайт и, следовательно, может компенсировать отсутствие Nrcam. Значимость взаимодействия между ankyrin G и такими компонентами перехвата была показана у мышей с отсутствием мозжечковой изоформы ankyrin G, у которых Na+ каналы, Ig-CAMs и spectrin βIV не группируются в начальном сегменте аксонов клеток Пуркинье. Похожую картину наблюдали у спонтанной мутации по spectrin βIV – QUIVERING мышей (или у мышей с прицельным нарушением этого гена), у которых найдены аномалии перехватов и измененное распределение каналов. Однако ankyrin G также присутствует в параузлах (paranodes) во время ранней миелинизации аксонов, что говорит не о его прямом участии в первичном таргетировании Na+ каналов, а скорее о его важности для их стабилизации. Кроме того, ankyrin G в норме локализован в перехватах у dystroglycan-null мышей, у которых показана значительная редукция кластеров перехватных Na+ каналов. После первичной кластеризации компонентов перехватов в волокнах ПНС, Nf155 и Caspr/Contactin комплекс аккумулируются в paranodal junction. После этого появляются Caspr2 и К+ каналы в juxtaparanodal области. Caspr2, К+ каналы и TAG-1 первыми определяются в параузлах (paranodes) и позже они перемещаются в juxtaparanodes как формы паранодального соединения (paranodal junction forms). В отсутствии такого соединения К+ каналы не перемещаются в juxtaparanodes и остаются рядом с перехватами (РИС.4; ТАБЛ.1 и 2). Дальнейшее поддержание К+ каналов в juxtaparanodal области требует Caspr2 и Tag1, поскольку в их отсутствии эти каналы перераспределяются по межперехватам.
Molecular sieves, pickets and fences. Сегрегация белков на отдельные домены в нейронах достигается через специфические сортировочные механизмы, за которыми следует закрепление и кластеризация этих белков в плазменной мембране. Формирование окружения перехвата Ранвье может включать несколько различных молекулярных механизмов (РИС.5). Удаление Na+ каналов с границ миелинизирующей глии во время развития может быть осуществлено с помощью селективной молекулярной фильтрации или «сита», обнаруженной в paranodes (РИС.5с). Предполагали, что такое «сито» не пропускает крупные белковые комплексы, включая Na+ каналы и Ig-CAMs, соединенные с ankyrin G, и пропускает мелкие мембранные частицы – соответствующие К+ каналам. Такой процесс требует аксоглиального контакта, но он не опосредуется Caspr/contactin комплексом, т.к. его отсутствие не препятствует кластеризации Na+ каналов в перехватах. Поэтому, появление зрелых, септ-содержащих (septa-containing) паранодальных соединений может быть необязательным для эффективной кластеризации Na+ каналов. Это мнение подтверждается данными freeze-fracture электронной микроскопии, при которой была показана ранняя дифференцировка перехватов еще до появления paranodal septa (паранодальной перегородки). Следовательно, накопление Caspr в параузлах и кластеризация Na+ каналов в перехватах происходит перед появлением septa (перегородки). Следует заметить, что постепенное открепление паранодальных петель (paranodal loops) в ЦНС у паранодальных мутантов сопровождается расширением пробела перехвата и рассеиванием Na+ каналов. Это указывает на то, что хотя septa и не является необходимым компонентом для первичной сборки Na+ каналов в перехватах, стабилизированные глиальные контакты (зависимые от septa) в paranodes могут быть необходимым компонентом для поддержания этих кластеров. Интересно, что кластеризация Na+ каналов в зрительном нерве Caspr-null мышей, у которых отсутствует paranodal septa, ассоциируется с кластерами соседних К+ каналов и это увеличивает вероятность того, что Caspr2 и Tag1 компенсируют в этих участках отсутствие Caspr и contactin.
В отличие от кластеризации Na+ каналов в перехватах, формирование septa- содержащих аксоглиальных соединений важно для изоляции К+ каналов в juxtaparanodes. Эти наблюдения указывают, что, будучи однажды сформированными, аксоглиальные septate соединения функционируют как барьер, ограничивающий движение этих каналов и других молекул из-под миелиновой оболочки к перехватам. Предполагается также, что молекулярное «сито», функционирующее в paranodes во время формирования перехватов, могло бы изменить эти свойства после того как paranodal loops уже обеспечат безопасность аксона посредством septate junction. Появление такого барьера может быть опосредовано прикреплением Caspr/contactin комплекса к цитоскелету аксона, связывающегося с глиальным лигандом, и сборкой специфических липидных микродоменов. И хотя вклад липидного состава мембраны в появление доменов аксона пока не изучен, интересно то, что contactin, Caspr и Tag1 ассоциируются с липидными плотиками (rafts).
Кроме paranodal junction возможно также существование мембранного барьера в перехватах. И хотя Caspr2/K+ канальный комплекс и Tag1 неправильно локализованы в паранодальной области в отсутствие paranodal junction, эти белки не проникают в перехваты, указывая на присутствие дополнительного барьера в этом участке. Такой барьер в области перехвата может быть сходен с диффузным барьером (или мембранным барьером), обнаруженным в начальном сегменте аксона, который можно рассматривать как первый перехват в большинстве миелинизированных аксонов. В начальном сегменте аксона этот барьер сформирован высоко концентрированными локальными трансмембранными белками, которые прикреплены к актиновому цитоскелету и которые служат в качестве «пикетов», способных блокировать диффузию мембранных белков и фосфолипидов. Интересно то, что интактный актиновый цитоскелет в аксонах ганглиев сетчатки также необходим для кластеризации Na+ каналов при воздействии растворимого фактора, секретируемого олигодендроцитами.
Рассматриваются два других молекулярных механизма, участвующих в формировании перехватов. В ПНС кластеризация перехватных Na+ каналов во время развития может быть опосредована контактирующими глиальными отростками, которые «тянут» Na+ каналы и Ig-CAMs по направлению к их окончательной позиции на аксолемме (РИС.5b). Это может быть осуществлено с помощью связывания Na+ каналов с микроворсинками Шванновских клеток, либо непосредственно через их β-субъединицы, либо косвенно через Nrcam и Nf186. Во время развития ERM-позитивные ворсинки Шванновских клеток осуществляют ранний контакт с перехватами во время их образования. Эти участки контактов (названные «caps») содержат phosphorylated adaptor EBP50 и face across axonal ankyrin G. Разрушение микроворсинок у мышей без dystroglycan в Шванновских клетках ведет к значительному снижению кластеризации Na+ каналов в узловых перехватах. Остается выяснить, связывает ли dystroglycan какие либо узелковые белки, опосредуя, таким образом, такое аксоглиальное взаимодействие.
Микроворсинки содержат также другие кандидатные белки, включая L1 и neurofascin, способные связывать Ig-CAMs, присутствующие в аксолемме. Наконец, возможно, что кластеризация Na+ каналов в перехватах Ранвье осуществляется с помощью downregulation этих каналов из нижних (from beneath) межперехватов и посредством селективной инсерции вновь синтезированных или рециклированных молекул в формирующийся узловой пробел (РИС.5d). Маловероятно, но во время развития может работать механизм «доставки». На это указывают такие наблюдения как перемещение изоформ Na+ каналов после формирования перехватов, присутствие высокой концентрации везикул в перехватах и тесная связь Na+ каналов с микротрубочками. Сходный механизм также может работать при формировании juxtaparanodes в ЦНС, где К+ каналы первыми определяются во время развития.
Видео:Клеточная мембрана: холестерин, белки-транспортеры, гликопротеины, гликолипидыСкачать

АКСОН И НЕРВНЫЙ ИМПУЛЬС
Генерация и распространение нервного импульса в организмах животных, возбуждение нервных и мышечных клеток — важнейшие мембранные явления. Мембранная теория возбуждения была сформулирована Бернштейном еще в 1902 г. [1]. Согласно его теории, возбуждение определяется электрохимическими процессами, локализованными в мембранах нервных и мышечных клеток. Эти процессы сводятся к перемещению малых ионов. Позднее Лазарев опубликовал монографию об ионной природе нервного возбуждения [2]. Исследования, проведенные Ходжки- ном, Катцем, Хаксли, Тасаки и другими учеными [3—6], раскрыли принципиальные механизмы генерации нервного импульса и его распространения (см. также [7—9]).
Нервное возбуждение распространяется по нервным волокнам— аксонам. Принято разделять нервную систему высших организмов на центральную и периферическую. Периферическая система содержит аксоны, служащие для передачи сигналов, а также ганглии вегетативной нервной системы. Аксоны являются коммуникациями для афферентных сообщений от органов чувств, направляемых в центральную систему, и для эфферентных сигналов, направляющихся от центральной системы к мышцам. Аксоны представляют собой отростки центрально расположенных клеток. Нервная система беспозвоночных имеет иное строение, но она также содержит коммуникационные аксоны.
Исследование генерации нервного импульса и его распространения в аксоне — старая и традиционная проблема биофизики/ Уже Гельмгольц измерял скорость распространения нервного возбуждения/В настоящее время решены важные физические задачи, относящиеся к функции аксона. Напротив, современное состояние науки позволяет лишь формально моделировать работу центральной нервной системы и мы еще далеки от понимания физической природы высших ее функций — памяти и мышления.
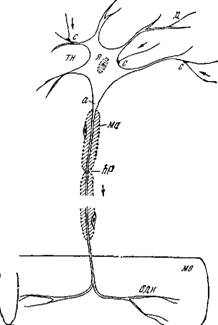
На рис. 4.1, заимствованном из [5], представлена схема строения нервной клетки, именуемой иначе нейроном. Нейрон полу
чает сообщения от многих других нейронов через их тонкие ответвления, образующие контакты — синапсы — с телом клетки и его короткими отростками — дендритами. Аксон имеет макроскопические протяженность и сечение. Длины аксонов в теле крупных животных достигают нескольких метров.
Контакты с другими клетками образуются не только в синапсах.^ Боль — шая часть поверхности нейрона покрыта прилегающими к нему глиальными, или иіванновскими, клетками^ роль которых пока не выяснена. С другой стороны^из мембран шванновских клеток образуется миелиновая оболочка миелинизирован — ных аксонов, показанная ^схематически на рис. 4.1. ^Оболочка прерывается через каждые 1—2 мм длины аксона перехватами Ранвье, имеющими протяженность /Т около 1 мкм. В области перехватов мембрана аксона непосредственно контактирует с окружающей средойЛ^
Немиелинизированные во — ЛОКНа могут быть объеди — Рис. 4.1. Схема строения нервной клетки нены одной шванновской (двигательный нейрон).
К-ТТР. ТКПЙ чтп ППКЯ1ЯНП R гр — і тн
тел0 нейрона,1Ца — аксои1Смо — миелиновая клеткой, ЧТО UOKdJdHU В се
оболочка, перехват Ранвье^д-дендрит,
ЧЄНИИ на рис. 4.2. Погру — X*— ядро,^с —синапсыЛодн—окончание двига о г — г тельного нерва,мв — мышечное волокно.
Женныи в шванНЬвскую 1
Клетку аксон создает глубокую инвагинацию мембраны шванновской клетки, причем образуется мезаксон — две шванновские мембраны, расположенные рядом^В правом нижнем углу схематически показана двойная мембрана, разделяющая цитоплазму шванновской клетки и цитоплазму аксона, аксоплазму [9].
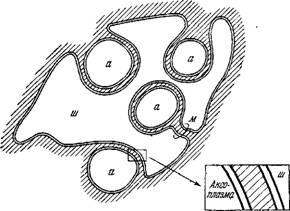
Герен [10] установила, что миелиновая оболочка аксона образована многократным спиральным закручиванием мембраны шванновской клетки вокруг аксоиаГМиелин представляет собой, — т-а«им
ойразом,/многослойную (доЧїбО слоев) мембрану, строение которой наблюдается с помощью электронного микроскопа. Миелии защищает мембрану аксона от окружающей среды.
6 М. В. Волькеиштейн
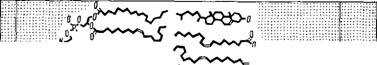
Структура миелина была детально изучена методом рентгенографии с разрешением 10 А [11]. Определены профили электронной плотности миелина седалищного нерва кролика и лягушки и миелина зрительного нерва кролика. На рнс. 4.3 показаны эти кривые для нервных волокон кролика и схема структуры миелина, соответствующая данным кривым. Миелин построен асимметрично, холестерин сосредоточен преимущественно на стороне
Рис. 4.2. Схема строения немиелинизированнного нервного волокна позвоночного.
А — аксон, м — мезаксон— шванновская клетка.
Миелина, соприкасающейся с мембраной аксона. Схема согласуется с липидным составом миелина млекопитающих, установленным ранее [12]. Белковые слои граничных областей миелина содержат йоду. Внутренняя область построена из гибких углевОдорОдных «хвостов» липидов.
/Уже давно установлено, что нервы и мышцы способны генерировать электродвижущие силы, биопотенциалы. Электрическая активность клеток проявляется в форме коротких разрядов, каждый из которых длится около 1 мс. Современная экспериментальная техника позволяет усиливать эти сигналы и регистрировать их с помощью осциллографа или другим путем. Установлено, что активность нерва всегда сопровождается электрическими явлениями — и при внешнем возбуждении и при посылке сигнала мозгом в соответствующем аксоне наблюдаются электрические импульсы. На рис. 4.4 показаны импульсы в зрительном нервном волокні краба Limulus, вызванные вспышкой света длительностью 1 с [13]. Частота и характер последовательности импульсов, имеющие несомненное информационное значе
ние, зависят от интенсивности и спектрального состава света [14, 15] (см. гл. 7) .1 Величина и длительность отдельного импульса не зависят отТгрироды и силы раздражения.»
Внугрен^/7о/тярже=Стероид щ^Гибх/гя ^Стероид ^//плярная Внешний
Нийбеяоцт. группы^ +ягесткая цепь +жесткая белок
+еоЗа ‘— » цепь — цепь — —
Рис. 4.3. Схема миелиновой мембранной структуры.
Вверх* — профили электронной плотности для глазного (пунктир) н седалищного (сплошная
Лнння) нервов кролика.
Электрический сигнал, отвечающий отдельному импульсу, распространяющемуся вдоль аксона, называется потенциалом действия или спайком. Это — основная единица информации, передаваемой по нервному волокну.
Скорость распространения импульса по аксону равна по порядку величины 1—100 м/с, она меньше для немиелинизиро — ванных и больше для миелинизированных аксонов.
Рис. 4.4. Импульсы в зрительном нервном волокне Limulus, вызванные вспышкой света длительностью I с.
Цифры справа указывают относительную интенсивность вспышки. Период освещения указан разрывом верхней белой линии, отметка времени на нижней белой линии 0,2 с.
В табл. 4.1 [3] приведены некоторые данные. Проведение нервного возбуждения есть проведение электрического импульса. Несмотря на то, что аксоплазма представляет
Скорость проведения возбуждения в нервном н мышечном волокнах
Видео:Потенциал действия. Миелиновые и безмиелиновые нейроны.Скачать

Передача потенциала действия по нервным волокнам
Передача потенциала действия по нервным волокнам
При передаче информации между различными участками нервной системы, отстоящими друг от друга на значительные расстояния, необходимо распространение нервных импульсов по аксонам нейронов. Скорость проведения зависит от толщины и наличия миелиновой оболочки. Имеется два типа нервных волокон: миелиновые и безмиелиновые. Оболочку безмиелиновых волокон образуют шванновские клетки, мембрана которых не имеет миелина. Оболочку миелиновых волокон в периферической нервной системе формируют шванновские клетки с миелином, а в ЦНС – сами олигодендроциты. Миелиновая оболочка через равные промежутки (0,5-2,0 мм) прерывается, образуя, свободные от миелина участки – узловые перехваты Ранвье. Протяженность этих перехватов в периферической нервной системе составляет 0,25 -1,0 мкм, а в волокнах ЦНС их длина достигает 14 мкм. Миелиновая оболочка нервных волокон выполняет изолирующую функцию, обеспечивает более экономное и быстрое проведение возбуждения.
В зависимости от толщины нервных волокон, наличия или отсутствия у них миелиновой оболочки все нервные волокна делят на три основных типа: А, В, и С.
1. Волокна типа А – это наиболее толстые, хорошо миелинизированные афферентые и эфферентые волокна соматичекой нервной системы. Скорость проведения этих волокон варьирует от 120 м/с до 15 м/с.
2. Волокна типа В слабомиелинизированные преганглионарные (парасимпатичесике) волокна вегетативной нервной системы. Скорость проведения составляет 5 – 14 м/с.
3. Волокна типа С – это немиелинизированные в основном постганглионарные (симпатические) волокна вегетативной нервной системы. Скорость проведения от 0,5 до 2,3 м/с.
Механизм проведения потенциала действия. Проведение возможно только при наличии на всем протяжении или ограниченных, но повторяющихся участках волокна потенциалзависимых ионных каналов, ответственных за формирование новых ПД. В распространении ПД можно выделить два этапа: этап распространения электрического поля, которое снижает МП, и этап генерации новых ПД в новых участках нервного волокна.
Электрическое поле – разновидность материи, посредством которой осуществляется силовое воздействие на электрические заряды, находящиеся в этом поле. Электрическое поле, которое генерируется биологическими структурами, является источником информации о состоянии клеток и органов организма.
В зависимости от расположения и концентрации ионных каналов в мембране нервного волокна имеются два варианта проведения ПД: непрерывный и сальтаторный.
Непрерывное проведение ПД происходит в безмиелиновых нервных волокнах (тип С), имеющих равномерное распределение потенциалзависимых ионных каналов по всей длине волокна, которое участвует в генерации ПД. Проведение нервного импульса начинается с распространения электрического поля. Амплитуда ПД в нервном волокне составляет 100-120 мВ. Расстояние, на котором сохраняется 37% величины ПД в виде электрического поля (постоянная длины мембраны), в немиелинизированных волокнах составляет от 0,1 до 1,0 мм. Возникший ПД за счет электрического поля деполяризует мембрану соседнего участка до критического уровня на постоянную длины мембраны (0,1 до 1,0 мм). Это означает, что на этом участке одновременно генерируются новые ПД, обусловленные движением ионов Na+ в клетку и ионов К+ из клетки. Число одновременно возникающих ПД ограничивается длиной возбужденного участка (от 0,1 до 1,0 мм для немиелинизированных волокон). ПД возникают рядом друг с другом в непосредственной близости. Причем сами ПД не перемещаются. Они исчезают там, где возникают. Главную роль в возникновении новых ПД играет передний ПД. Вспомогательную роль в генерации новых ПД в невозбужденных участках нервного волокна играют соседние ПД (возникшие сзади переднего ПД), так как их электрическое поле суммируется с электрическим полем переднего ПД. Таким образом, непрерывное распространение нервного импульса идет через генерацию новых ПД по эстафете, когда каждый участок мембраны сначала выступает как раздражаемый электрическим полем, а затем как раздражающий (в результате формирования в нем новых ПД).
Рис.1. Непрерывное проведение ПД по немиелинизированному нервному волокну.
Сальтаторное проведение ПД по миелинизированным волокнам является эволюционно более поздним механизмом. Оно происходит в волокнах типа А и В (миелинизированных), для которых характерна концентрация потенциалзависимых ионных каналов только в небольших участках мембраны – в перехватах Ранвье. В области миелиновых муфт, обладающих хорошими изолирующими свойствами, потенциалзависимых каналов нет, поэтому ПД здесь не возникают. Участок нервного волокна, покрытый миелиновой муфтой, в механизме проведения потенциала действия играет роль изолятора. В этих условиях ПД, возникший в одном перехвате Ранвье, за счет электрического поля деполяризует мембрану соседних перехватов до критического уровня, что приводит к возникновению в них новых ПД, то есть возбуждение проводится скачкообразно от одного перехвата к другим. Так как, Nа+- каналы начинают открываться при достижении деполяризации клеточной мембраны 50%-ов, а постоянная длины мембраны миелинизированного волокна составляет 5 мм, то электрическое поле ПД на данном расстоянии сохраняет 37% своей амплитуды (это около 30 мВ) и может деполяризовать мембрану до критического уровня (пороговый потенциал в перехватах равен 15 мВ) не только соседнего перехвата, но и вплоть до пятого. Поэтому возбуждение распространяется очень быстро по всей длине волокна. При этом ионы движутся только перпендикулярно относительно длины волокна. Электрическое поле потенциалов действия, возникших сзади переднего ПД, суммируется с его электрическим полем, так как и при непрерывном распространении возбуждения. Следовательно, сальтаторное проведение возбуждения обусловлено генерацией новых ПД по эстафете, когда каждый перехват Ранвье сначала выступает как раздражаемый электрическим полем, а затем как раздражающий соседние перехваты.
Рис.2. Сальтаторное проведение ПД в миелинизированном нервном волокне.
Возникающие ПД не могут инициировать возникновение других ПД в обратном направлении, так как нервное волокно находится еще в рефрактерном состоянии. В натуральных условиях первый потенциал действия, инициирующий распространение возбуждения по аксону, возникает в аксонном холмике, а возбуждение проводится только в одном направлении – по аксону к другой клетке.
Сравнение непрерывного и сальтаторного проведения возбуждения показывает, что различие в механизме проведения возбуждения по миелинизированным и немиелинизированным нервным волокнам заключается в том, что очередные ПД в безмякотном волокне возникают на более близком расстоянии друг от друга, так как ионные каналы расположены близко и непрерывно по всей длине. Поэтому такое проведение и назвали непрерывным. Число одновременно возникающих ПД в мякотном волокне строго ограничено числом возбужденных перехватов – максимально 5.
Сальтаторное проведение возбуждения имеет два важных преимущества по сравнению с непрерывным проведением возбуждения.
1. Сальтаторное проведение более экономично в энергетическом плане, так как возбуждаются только перехваты Ранвье, площадь которых имеет 1% мембраны, и, следовательно. Надо меньше энергии для восстановления трансмембранных градиентов Nа+ и К+, расходующихся в процессе возникновения ПД.
2. Возбуждение в миелинизированных волокнах проводится с большей скоростью, чем в безмиелиновых волокнах, так как в них электрическое поле ПД в области миелиновых муфт распространяется значительно дальше – на соседние перехваты Ранвье, поскольку электроизоляция уменьшает рассеивание электрического поля. Кроме того, миелинизированные волокна в большинстве своем тольще немиелинизированных, что также ускоряет проведение возбуждения, поскольку электрическое сопротивление более толстых волокон меньше.
Время распространения ПД в миелинизированных и немиелинизированных нервных волокнах определяется только временем возникновения ПД, то есть перпендикулярным относительно мембраны движением ионов в клетку и из клетки, поскольку электрическое поле распространяется мгновенно.
Характеристика проведения возбуждения по нервным волокнам.
1. Нервные волокна могут проводить возбуждения в двух направлениях. В эксперименте при раздражении любого участка нерва, ПД распространяется в обе стороны от места раздражения.
2. Возбуждение проводится изолировано в каждом нервном волокне.
3. Большая скорость проведения возбуждения (до 120 м/с). По сравнению – гуморальное проведение информации по организму совершается за 22 с.
4. Малая утомляемость нервного волокна. При нормальной доставке кислорода и питательных веществ к нервному волокну – оно практически не утомляемо, так как расход энергии в нем очень мал.
5. Возможность функционального блока проведения возбуждения при морфологической целостности волокон. Наличие явления парабиоза – функциональных изменений в нерве после действия на него длительных и сильных раздражений. Причиной блока проведения возбуждения является инактивация Nа+ — каналов.
Аксонный транспорт. Основная масса веществ, образующихся в теле нейрона, используется в различных его отделах. Различают аксонный транспорт и дендритный. Аксонный транспорт изучен лучше. Он делится на быстрый и медленный.
1. Быстрый аксонный транспорт идет в двух направлениях: от тела клетки до аксонных окончаний – антеградный транспорт, и в противоположном направлении – ретроградный транспорт. Посредством антеградного транспорта в окончания аксона доставляются ферменты, медиаторы, липиды, везикулы, содержащие гликопротеины мембран. При помощи ретроградного транспорта в тело нейрона переносится везикулы, содержащие остатки разрушенных структур, фрагменты мембран, ацетилхолинэстераза. В патологическиъ условиях по аксону к соме могут транспортироваться вирусы бешенства, герпеса, полиомиелита, столбнячный токсин. Быстрый аксонный транспорт осуществляется с помощью специальных структурных элементов нейрона: микротрубочек и микрофиламентов. Для транспорта необходима энергия АТФ.
2. Медленный аксонный транспорт осуществляется только в антеградном направлении и представляет собой передвижение всего столба аксоплазмы. С помощью медленного транспорта перемещаются белки микротрубочек и микрофиламентов, ферменты цитозоля, РНК, белки каналов, насосов.
Аксонный транспорт играет важную роль также и при регенерации поврежденных нервных волокон.
🎦 Видео
Биохимия. Лекция 28. Строение клеточной мембраныСкачать

Структура клеточной мембраны и виды мембранного транспортаСкачать

Рецепторная функция мембраны Часть 01Скачать

Плазматическая мембрана. 10 класс.Скачать

Мембрана клетки и транспорт через Горячев А.С.Скачать

Цитология. Плазматическая мембрана. Ч.2. Липидный состав.Скачать

Мембранные потенциалы - Часть 1Скачать
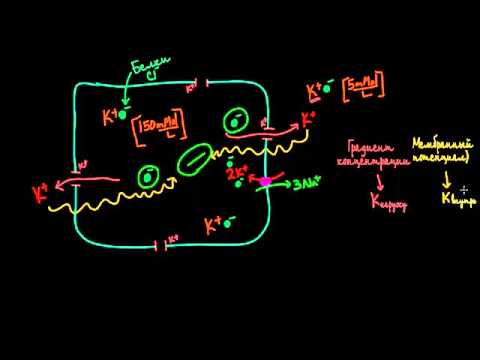
Строение клеточной мембраныСкачать

Электрическая сигнализация. Часть 2. Биопотенциалы. Законы реагирования возбудимых тканейСкачать

Д.С. Дружинин Редкие атипичные варианты ХВДП: вопросы дифференциальной диагностикиСкачать

Урок№3 - Клеточная Мембрана - ПЛАЗМАЛЕММА - Строенеие КлеткиСкачать

12-00 13-40 Нормальная физиология. Физиология возбудимых тканейСкачать

Нервная ткань-2. Видеолекция С.М.Зиматкин (10)Скачать

Плазматическая мембрана - Евгений ШевальСкачать

Каменский А. А. - Физиология человека и животных - Калиевые каналы. Проводимость. Аксонный транспортСкачать

Ионные каналы Приезжева ОЛД218Скачать

Биология. Зыбина А. М. 9 класс. Физиология. Мембранный потенциал. Потенциал действия. Работа мышц.Скачать

БФ - Мембранные потенциалыСкачать