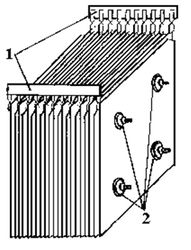
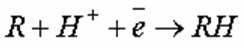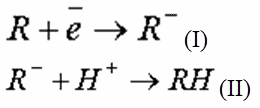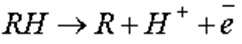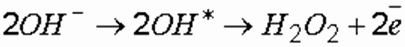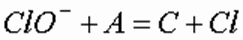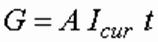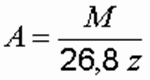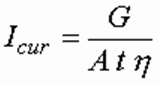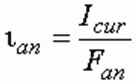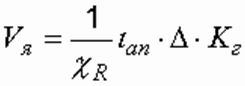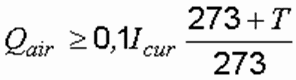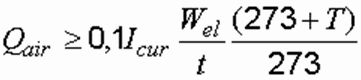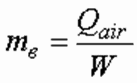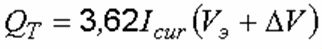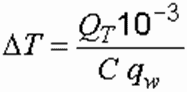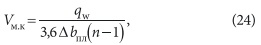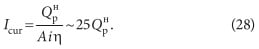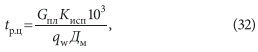- Физико-химические основы электрохимической обработки воды
- Электролиз воды
- Расчет основных параметров процесса электролиза воды
- Конструкции электролизеров воды
- Бытовые электрохимические реакторы
- Заключение
- Литература
- Технологический расчет установок электрокоагуляции воды
- Электролиз воды с индуктивного напряжения импульсов
- 1. Введение
- 2. Обзор литературы
- 2.1. КРАТКАЯ ИСТОРИЯ ЭЛЕКТРОЛИЗА ВОДЫ
- 2.2. ПОСТОЯННЫЙ ТОК ЭЛЕКТРОЛИЗА ВОДЫ
- 2.3. ИНТЕРФЕЙС МЕЖДУ ЭЛЕКТРОДОМ И ЭЛЕКТРОЛИТОМ: ДВОЙНОЙ СЛОЙ
- 2.4. ВОДА РАСЩЕПЛЕНИЕ С ИМПУЛЬСНЫМ ЭЛЕКТРОЛИЗОМ
- 3. Экспериментальная
- 3.1. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ
- 3.2. ГЕНЕРАТОР ИНДУКТИВНЫЙ ОБРАТНОЕ НАПРЯЖЕНИЕ ИМПУЛЬСА
- ТАБЛИЦА 1.
- ТАБЛИЦА 2.
- 🎬 Видео
Видео:🔥 ЭЛЕКТРОЛИЗ ВОДЫ. ЛУЧШИЕ ЭЛЕКТРОДЫ ДЛЯ ПОЛУЧЕНИЯ ВОДОРОДА И КИСЛОРОДА.Скачать

Физико-химические основы электрохимической обработки воды
Явление электрохимической активации воды (ЭХАВ) – совокупность электрохимического и электрофизического воздействия на воду в двойном электрическом слое (ДЭС) электродов (анода и катода) при неравновесном переносе заряда через ДЭС электронами и в условиях интенсивного диспергирования в жидкости образующихся газообразных продуктов электрохимических реакций.
В процессе ЭХАВ происходят четыре основных процесса:
1) Электролитическое разложение воды (электролиз) за счет окислительно-восстановительных реакций на электродах, обусловленных внешним постоянным электрическим полем;
2) Электрофорез – движение в электрическом поле положительно заряженных частиц и ионов к катоду, а отрицательно заряженных частиц и ионов к аноду;
3) Электрофлотация – образование газовых флокул и агрегатов, состоящих из мелкодисперстных пузырьков газа (водорода на катоде и кислорода на аноде) и грубодисперстных примесей воды;
4) Электрокоагуляция – образование коллоидных агрегатов частиц осаждаемой дисперсной фазы за счет процесса анодного растворения металла и образования катионов металлов Al 3+ , Fe 2+ , Fe 3+ под воздействием постоянного электрического поля .
В результате обработки воды постоянным электрическим током, при потенциалах равных или превышающих потенциал разложения воды (1,25 V) вода переходит в метастабильное состояние, характеризующееся аномальными значениями активности электронов и других физико-химических параметров (рН, E h, ОВП, электропроводность) [1]. Прохождение постоянного электрического тока через объем воды сопровождается электрохимическими процессами, в результате которых происходят окислительно-восстановительные реакции, приводящие к деструкции (разрушению) водных загрязнений, коагуляции коллоидов, флокуляции грубодисперсных примесей и их последующей флотации.
Электрохимическая обработка применяется для осветления и обесцвечивания природных вод, их умягчения, очистки от тяжелых металлов (Cu, Co, Cd, Pb, Hg), хлора, фтора и их производных, для очистки сточных вод, содержащих нефтепродукты, органические и хлорорганические соединения, красители, СПАВ, фенол [2]. Достоинствами электрохимической очистки воды является то, что она позволяет корректировать значения водородного показателя рН и окислительно-восстановительного потенциала Е h, от которого зависит возможность протекания различных химических процессов в воде; повышает ферментивную активность активного ила в аэротенках; уменьшает удельное сопротивление и улучшает условия коагуляции и седиментации органических осадков [3].
В 1985 г ЭХАВ была официально признана в качестве нового класса физико-химических явлений. Поручением правительства РФ от 15 января 1998 г. № ВЧ-П12-01044 даны рекомендации министерствам и ведомствам использовать данную технологию в медицине, сельском хозяйстве, промышленности.
Видео:Вода для электролиза и возможные проблемы с электролизеромСкачать

Электролиз воды
Основной стадией электрохимической обработки воды является электролиз воды. При пропускании постоянного электрического тока через воду, поступление в воду электронов у катода, так же как и удаление электронов из воды у анода, сопровождается серией окислительно-восстановительных реакций на поверхности катода и анода. В результате образуются новые вещества, изменяется система межмолекулярных взаимодействий, состав воды, в том числе структура воды [4].
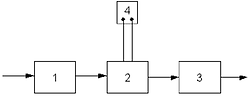
Типовая установка для электрохимической обработки воды состоит из блока подготовки воды (1), электролизера (2), блока обработки воды после электрохимической очистки (3) (рис. 1).
Рис. 1. Схема установки для электрохимической обработки воды: 1 – блок подготовки воды; 2 – электролизер; 3 – блок доочистки; 4 –выпрямитель электрического тока. В некоторых установках электрохимической обработки воды предусматривается предварительная механическая очистка воды, уменьшающая опасность засорения электролитической ячейки грубодисперсными примесями с большим гидравлическим сопротивлением. Блок для механической очистки воды необходим, если в результате электрохимической обработки вода насыщается грубодисперсными примесями, например хлопьями гидрооксидов металлов (Al(OH) 3, Fe(OH) 3, Mg(OH) 2) после электрокоагуляции. Основным элементом установки является – электролизер, состоящий из одной или нескольких электролизных ячеек (рис. 2).
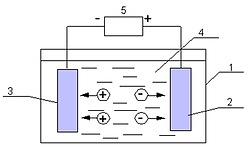
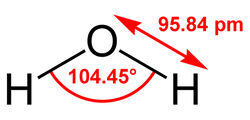
Рис. 2. Схема электролизной ячейки: 1 – корпус; 2 – анод; 3 – катод; 4 – межэлектродное пространство; 5 – источник постоянного тока. Электролизная ячейка образована двумя электродами – положительно заряженным анодом и отрицательно заряженным катодом, присоединенными к разным полюсам источника постоянного тока. Межэлектродное пространство заполнено водой, являющейся электролитом, способным проводить электрический ток. В результате работы прибора происходит перенос электрических зарядов через слой воды – электрофорез, т.е. миграция полярных частиц, носителей зарядов — ионов, к электродам, имеющим противоположный знак. При этом к аноду перемещаются отрицательно заряженные — анионы, а к катоду – положительно заряженные катионы. У электродов заряженные ионы теряют заряд, деполяризуются, превращаясь в продукты распада. Кроме заряженных ионов в электрофорезе участвуют полярные частицы различной дисперсности, включая и грубодисперсные (эмульгированные частицы, пузырьки газов и др.), но главную роль в переносе электрохимических зарядов играют обладающие наибольшей подвижностью заряженные ионы. К полярным частицам относятся полярные частицы из числа водных примесей и молекулы воды, что объясняется их особой структурой. Входящий в состав молекулы воды центральный атом кислорода, имеющий большую электроотрицательность, чем атомы водорода, оттягивает на себя электроны, придавая молекуле асимметричность. В результате происходит перераспределение электронной плотности: молекула воды поляризуется, принимая свойства электрического диполя (дипольный момент 1,85 дебая) с положительным и отрицательным зарядами на полюсах (рис. 3).
Рис. 3. Структура молекулы воды Продуктами электродных реакций являются обезвреженные водные примеси, газообразные водород и кислород, образующиеся при электролитическом разрушении молекул воды, катионы металлов (Al 3+ , Fe 2+ , Fe 3+ ,) в случае применения металлических анодов из аллюминия и стали, молекулярный хлор и др. При этом на катоде генерируется газообразный водород, а на аноде – кислород. В составе воды содержится некоторое количество иона гидроксония Н 3О + , деполяризующегося на поверхности катода с образованием атомарного водорода Н . :
В щелочной среде Н 3О + отсутствует, но происходит разрушение молекул воды, сопровождающееся образованием атомарного водорода Н . и гидроксид-иона ОН — :
Реакционноспособные атомы водорода адсорбируются на поверхностях катодов и после рекомбинации образуют молекулярный водород Н 2 , выделяющийся из воды в газообразном виде:
Одновременно у анодов происходит выделение атомарного кислорода. В кислой среде этот процесс сопровождается разрушением молекул воды:
В щелочной среде источником образования кислорода служат гидроксид-ионы ОН — , перемещающиеся под действием электрофореза от катода к аноду:
Нормальные окислительно-восстановительные потенциалы этих реакций: +1,23 V и +0,403 V, соответственно, но процесс протекает в условиях некоторого перенапряжения.
Электролизную ячейку можно рассматривать в качестве генератора вышеназванных продуктов, некоторые из которых, вступая в химическое взаимодействие между собой и с водными загрязнениями в межэлектродном пространстве, обеспечивают дополнительную химическую очистку воды (электрофлотация, электрокоагуляция) [5]. Эти вторичные процессы происходят не на поверхности электродов, а в объеме воды. Поэтому в отличие от электродных процессов они обозначаются объемными. Они инициируются повышением температуры воды в процессе электролиза и увеличением значения рН при катодном разрушении молекул воды.
Различают катодное и анодное окисление. При катодном окислении молекулы органических веществ, сорбируясь на катодах, акцептируют свободные электроны, восстанавливаются, трансформируясь в в соединения, не являющиеся загрязнениями. В одних случаях процесс восстановления проходит в один этап:
где R – органическое соединение; RH – гидратированная форма соединения, не являющаяся загрязнением.
В других случаях катодное восстановление проходит в два этапа: на первом этапе (I) органическая молекула превращается в анион, на втором (II) – анион гидратируется, взаимодействуя с протоном воды:
Катоды из материалов, требующих высокого перенапряжения (свинец, кадмий), позволяют при большой затрате электроэнергии разрушать органические молекулы и генерировать реакционноспособные свободные радикалы — частицы, имеющие на внешних орбитах атомов или молекул свободные неспаренные электроны (Cl*, O*, ОН*, НО 2* и др.). Последнее обстоятельство придает свободным радикалам свойство реакционноспособности, т.е. способости вступать в химические реакции с водными примесями и разрушать их.
При анодном окислении молекулы органического вещества, адсорбируясь на аноде, отдают электроны с одновременной или с предшествующей гидратацией:
Анодное окисление органических соединений часто приводит к образованию свободных радикалов, дальнейшие превращения которых определяются их реакционной способностью. Процессы анодного окисления многостадийны и протекают с образованием промежуточных продуктов. Анодное окисление снижает химическую устойчивость органических соединений и облегчает их последующую деструкцию в ходе объемных процессов [6].
В объемных окислительных процессах особую роль играют продукты электролиза воды – кислород (О 2), перекись водорода (Н 2О 2) и кислородосодержащие соединения хлора (HClO). В процессе электролиза образуется чрезвычайно реакционноспособное соединение — Н 2О 2, формирование молекул которой происходит за счет гидроксил-радикалов (ОН * ), являющихся продуктами разрядки на аноде гидроксил-ионов (OH — ):
где ОН * – гидроксил-радикал.
Реакции взаимодействия органических веществ с окислителями протекают в течение определеного промежутка времени, длительность которого зависит от величины окислительно-восстановительного потенциала элемента и концентрации реагирующих веществ. По мере очистки и снижения концентрации загрязняющего вещества процесс окисления уменьшается.
Скорость процесса окисления при электрохимической обработке зависит от температуры обрабатываемой воды и от рН. В процессе окисления органических соединений образуются промежуточные продукты, отличающиеся от исходного как устойчивостью к дальнейшим превращениям, так и показателями токсичности.
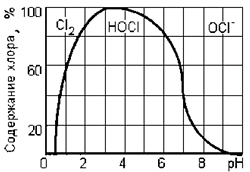
Источником получения активного хлора и его кислородосодержащих соединений, генерируемых в электролизере, являются хлориды, находящиеся в обрабатываемой воде, и хлористый натрий (NaCl), который вводится в обрабатываемую воду перед электролизом. В результате анодного окисления анионов Cl — генерируется газообразный хлор Cl 2. В зависимости от рН воды он либо гидролизуется с образованием хлорноватистой кислоты HOCl, либо образует гипохлорит-ионы ClO — . Равновесие реакции зависит от значения рН. При рН = 4–5 весь хлор находится в форме хлорноватистой кислоты (HClO), а при рН = 7 половина хлора в форме гипохлорит-иона (OCl — ) и половина – в виде хлорноватистой кислоты (HClO) (рис. 4).
Рис.4. Содержание (%) различных форм хлора (Cl 2, HOCl, OCl — ) в воде в зависимости от рН. Механизм взаимодействия гипохлорит-иона (ClO — ) с окисляемым веществом описывается следующим уравнением:
где А – окисляемое вещество; С – продукт окисления.
Электрохимическое окисление органических соединений гипохлорит-ионом (ClO — ) сопровождается увеличением окислительно-восстановительного потенциала E h, что указывает на преобладание окислительных процессов [7]. Рост E h зависит от отношения концентрации активного хлора в межэлектродном пространстве к содержанию органических примесей в воде. По мере очистки и уменьшения количества загрязнений это соотношение возрастает, что приводит к увеличению E h, но потом этот показатель стабилизируется.
Количество вещества, прореагировавшего на электродах при пропускании постоянного электрического тока по закону Фарадея, прямо пропорционально силе тока и времени обработки:
где А – электрохимический эквивалент элемента, г/А ч; I cur – сила тока, А; t – время обработки, ч.
Электрохимический эквивалент элемента определяется по формуле:
где М – атомная масса элемента, г; z – его валентность.
Значения электрохимических эквивалентов некоторых элементов приведены в табл. 1.
Таблица 1. Электрохимические эквиваленты некоторых элементов
Электрохимический эквивалент вещества А, г/А ч
Фактическое количество вещества, генерируемого при электролизе, меньше теоретического, рассчитанного по формуле (1), так как часть электроэнергии затрачивается на нагревание воды и электродов. Поэтому при расчетах учитывается коэффициент использования тока η 0 С (табл. 2).
Таблица 2. Электродные потенциалы некоторых элементов
- Электродная реакция; Потенциал [V]; Электродная реакция; Потенциал [V]
- Al → Al3+ + 3e-; -1,66; Cu → Cu2+ + e-; +0,345
- Zn → Zn2+ + 2e-; -0,763; 4OH- → 2H2O + O2 + 4e-; +0,401
- Fe → Fe2+ + 2e-; -0,44; 2H2O → O2 + 4H+ + 4e-; +1,23
- Cd → Cd2+ + 2e-; -0,403; 2Cl- → Cl2 + 2e-; +1,36
- H2 → 2H+ + 2e-; 0,0001; Cl- + H2O → HClO + H+ + 2e-; +1,49
Напряжения, генерируемые в электродной ячейке, должны быть достаточными для возникновения окислительно-восстановительных реакций на электродах. Значение напряжения зависит от ионного состава воды, наличия в воде примесей, например СПАВ, плотности тока (его сила отнесенная к единице площади электрода), материала электродов и др. При прочих равных условиях задача выбора электродного материала заключается в том, чтобы для прохождения окислительно-восстановительных реакций на электродах, требуемое напряжение было минимальным, поскольку это позволяет снизить затраты электроэнергии.
Некоторые окислительно-восстановительные реакции являются конкурирующими — протекают одновременно и взаимно тормозят друг друга. Их протекание возможно регулировать за счет изменения напряжения в электролитической ячейке. Так, нормальный потенциал реакции образования молекулярного кислорода составляет +0,401 V или +1,23 V; при увеличении напряжения до +1,36 V (нормальный потенциал реакции образования молекулярного хлора) на аноде будет выделяться только кислород, а при дальнейшем увеличении потенциала – одновременно и кислород, и хлор, причем выделение хлора будет происходить с недостаточной интенсивностью. При напряжении около 4–5 V выделение кислорода практически прекратится, и электролитическая ячейка будет генерировать только хлор.
Видео:Магнитный электролизерСкачать

Расчет основных параметров процесса электролиза воды
К основным параметрам электролиза воды относятся сила и плотность тока, напряжение в пределах электродной ячейки, а так же скорость и продолжительность пребывания воды в межэлектродном пространстве.
Сила тока I cur – величина, определяемая в зависимости от требуемой производительности по генерируемому продукту, А, определяется по формуле:
Эта формула получена путем преобразования формулы (1) с учетом коэффициента использования тока η.
Плотность тока – его сила, отнесенная к единице площади электрода, А/м 2 , например анода, определяется из выражения:
где F an – площадь анода, м 2 .
Плотность тока оказывает определяющее влияние на электролиз: с увеличением плотности тока интенсифицируются электродные процессы и уменьшается площадь поверхности электродов, но одновременно возрастают напряжение в электролизной ячейке и как следствие энергоемкость процесса [8]. Повышенное увеличение плотности тока интенсифицирует выделение электролизных газов, приводящее к бурлению и диспергированию нерастворимых продуктов электрообработки воды. При увеличении плотности тока также усиливается пассивация электродов, заключающаяся в блокировке поступающих электронов поверхностными отложениями анода и катода, что увеличивает электрические сопротивления в электродных ячейках и тормозит окислительно-восстановительные реакции, протекающие на электродах.
Аноды пассивируются в результате образования на их поверхностях тонких оксидных пленок, в результате сорбции на анодах кислорода и других компонентов, которые, в свою очередь, сорбируют частицы водных примесей. На катодах образуются, в основном, карбонатные отложения, особенно в случае обработки воды с повышенной жесткостью. В силу этих причин плотность тока при электролизе воды должна назначаться минимальной по условиям устойчивого протекания необходимых окислительно-восстановительных реакций в ходе технологического процесса.
Напряжение в электродной ячейке, В, определяется по формуле
где ί an – плотность тока, А/м 2 ; ∆ – расстояние между электродами (ширина межэлектродного канала), м; χ R – удельная электропроводность воды, 1/(Ом . м); К г – коэффициент газонаполнения межэлектродного пространства, К г = 1,05–1,2.
Формула (5) не учитывает электрических сопротивлений электрода в связи с их низкими значениями, но при пассивации эти сопротивления оказываются значительными. Ширина межэлектродного канала принимается минимальной (3–20 мм) по условиям незасорения примесями.
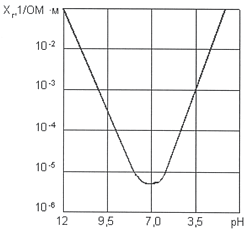
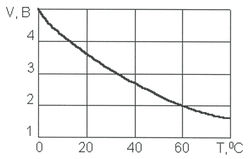
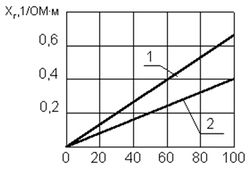
Рис. 5. Зависимость удельной электропроводности от рН воды при t = +5 0 C Удельная электропроводность воды χ R зависит от ряда факторов, среди которых наиболее существенны температура, рН, ионный состав и концентрация ионов (рис. 5). С увеличением температуры электропроводность χ R увеличивается, а напряжение уменьшается (рис. 6). Минимальное значение электропроводности соответствует значению рН = 7. Кроме этого, в процессе электролиза происходит повышение температуры и рН воды. Если рН >7, то можно ожидать уменьшения удельной электропроводности воды χ R, а при значениях рН R, наоборот, возрастает (рис. 5).
Рис. 6. Зависимость напряжения на электродах от температуры воды. Удельная электропроводность природных вод средней минерализации составляет 0,001–0,005 1/(Ом . м), городских сточных вод 10–0,01 1/(Ом . м) [9]. При электролизе удельная электропроводность должна быть в пределах 0,1–1,0 1/(Ом . м) [10]. В случае, если исходная вода имеет недостаточную электропроводность, следует увеличить солесодержание (рис. 7). Обычно для этого используют хлористый натрий (NaCl), дозы которого определяются экспериментально и чаще всего составляют 500–1500 мг/л (8–25 мг-экв/л) [11]. Хлористый натрий не только удобен по условиям применения и безопасности (хранение, приготовление раствора и т.д.), но в присутствии NaCl замедляется пассивация электродов. Диссоциируя в воде, NaCl насыщает воду анионами хлора Cl — и катионами натрия Na + . Ионы хлора Cl — имеют небольшие размеры и проникая через пассивирующие отложения к поверхности анода разрушают эти отложения. В присутствии других анионов, особенно сульфат ионов (SO 4 2- ), депассивирующее влияние ионов хлора (Cl — ) уменьшается. Устойчивая работа электролизера возможна в случае, если ионы Cl — составляют не менее 30% от общего количества анионов. Катионы натрия Na + в результате электрофореза перемещаются к катодам, на которых генерируются гидроксид-ионы ОН — , и, взаимодействуя с последними, образуют гидроксид натрия (NaОН), растворяющий карбонатные отложения на катодах.
Рис. 7. Зависимость электропроводности от концентрации анионов хлора : 1 — при t= +25 0 С; 2 — при t= +5 0 С
Потребляемая мощность, Вт, электролизера определяется по зависимости (6):
где η э – коэффициент полезного действия электролизера, η э = 0,7–0,8; I cur – сила тока, A, V э – напряжение на электролизере, V.
Продолжительность пребывания воды в межэлектродном пространстве электролизера ограничивается временем, необходимым для генерации нужного количества продуктов электролиза, а также продолжительностью соответствующих объемных реакций, и определяется экспериментально.
Скорость движения воды в межэлектродом пространстве задается с учетом условий выноса из электролизера продуктов электролиза и других примесей; кроме того, от скорости движения воды зависит турбулентное перемешивание, что влияет на ход объемных реакций. Как и продолжительность пребывания воды, скорость воды выбирается на основании экспериментальных данных.
Видео:Оптимальный зазор при электролизе, новый вытеснитель, дождевая вода, светопоглащение | Водород-04Скачать

Конструкции электролизеров воды
Современные электролизеры представляют собой камеры различных конфигураций, в которых размещены электроды. Камеры выложены листовым винипластом или текстолитом для защиты от воздействия хлора, его кислородных соединений и других окислителей.
Электролиз воды сопровождается интенсивным пеновыделением, поэтому электролизер оборудуется специальными устройствами и пеногасителями для ее удаления. В целях защиты электродов и межэлектродного пространства от засорения пеной и нерастворимыми продуктами электролиза предусматриваются устройства для очистки межэлектродного пространства путем продувки сжатым воздухом или при помощи специальных диэлектрических щеток, которые предназначаются и для механической депассивации электродов. Электроды имеют форму пластин с центральным отверстием, через которое проходит вал с жестко закрепленными на нем скребками (щетками), заведенными в межэлектродные зазоры. При повороте вала происходит контакт щеток с электродами, что позволяет очищать их от твердых отложений.
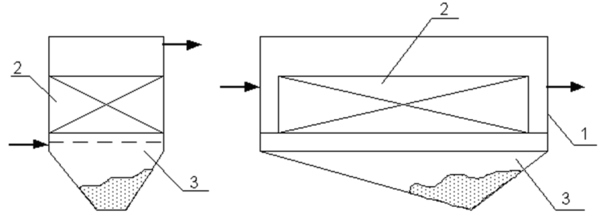
Если вода содержит грубодисперсные примеси с большим гидравлическим сопротивлением, предусматривается специальная иловая камера для накопления выпадающих осадков (рис. 8).
Рис. 8. Схемы электролизеров с осадконакопителями: 1 – корпус; 2 – блок электродов; 3 – осадконакопитель
В зависимости от направления движения воды электролизеры бывают горизонтального или вертикального типов (рис. 9). Вертикальная установка занимает меньшую площадь, но имеет большую высоту, что усложняет высотную схему сооружения.
Рис. 9. Схемы электродных камер: а – горизонтальная прямоугольная; б – вертикальная прямоугольная или круглая; в – то же с горизонтальным расположением электродов; 1 – корпус; 2 – электроды; 3 – распределительная решетка; 4 – блок электропитания; 5 – анод; 6 – катод в виде сетки.
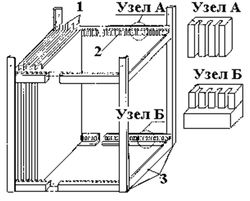
Электроды выполняются в виде стрежней, дисков, сеток и т.д., но чаще всего представляют собой металлические стальные пластины толщиной от 3 до 10 мм. Во избежание химической коррозии их размеры составляют 1,5–1,8 м. Пластины собираются в пакеты при помощи диэлектрических стягивающих зажимов либо устанавливаются в пазы специальных рам из диэлектриков (рис.10, рис. 11).
Рис. 10. Схема электродной системы пазного типа. 1 – электроды; 2 – контактные пазы; 3 – рама. По условиям монтажа и ремонтопригодности вес пластин или пакетов пластин должен составлять не более 50–100 кг. Поэтому при необходимости в корпусе электролизера может размещаться несколько пакетов пластин.
Рис. 11. Схема электродной системы пакетного типа: 1 – токораспределительные пластины; 2 – стягивающие зажимы. Электроды присоединяются к источнику электропитания по монополярной или по биполярной схеме. В последнем случае каждый электрод работает одной поверхностью как анод, а другой – как катод. Биполярная схема требует меньшего количества присоединений электродов к источнику питания, но при этом увеличивается напряжение на электродах. Если при монополярном присоединении оно равно напряжению в пределах одной электродной ячейки, т.е. V э = V я, то при биполярной напряжение на электродах зависит от количества ячеек, n:
где n – количество ячеек, шт.
Материал электродов должен обладать рядом обязательных свойств:
1) химической устойчивостью и инертностью к среде, в которой производится электролиз;
2) оптимальными электрохимическими характеристиками по отношению к окислительно-восстановительным реакциям;
3) механической прочностью и химической устойчивостью.
Аноды (за исключением установок для электрокоагуляции) не должны растворяться при электролизе. Нерастворимые аноды изготавливаются титановыми с защитными покрытиями из платины, оксидов кобальта (ОКТА), диоксида марганца (ТДМА), оксидов рутения и титана (ОРТА) [12]. Возможно применение анодов из графита или графитизированного угля, но эти материалы недостаточно прочны и долговечны. В электрокоагуляторах аноды выполняются растворимыми из алюминия и его сплавов, а также из железа.
В процессе электролиза всегда генерируются газообразные водород и кислород. Смесь этих газов взрывоопасна, а смесь водорода с воздухом обладает взрывоопасностью при концентрации водорода более 4 об.%. Согласно условиям безопасности электролизеры оборудуются системами вытяжной вентиляции, обеспечивающими разбавление выделяющегося водорода воздухом до концентрации менее 0,4 об.%, т.е. в 10 раз ниже порога взрывоопасности.
Производительность вентиляционных установок для электролизеров непрерывного действия, м 3 /ч рассчитывается по формуле:
где t – температура обрабатываемой воды, 0 С.
Если электролизер периодического действия, то формула принимает вид:
где W el – полезная вместимость электродной камеры, м 3 ; t – продолжительность обработки, ч.
В случаях, когда применяется открытый электролизер и генерируемый водород поступает непосредственно в помещение, кратность воздухообмена, 1/ч, расчитывается из формулы:
где W – объем помещения, м 3 .
Электролиз воды всегда сопровождается выделением тепла и нагревом обрабатываемой воды, что может повлиять на условия ее последующего использования или выпуска в систему водоотведения.
Расход выделяющегося при электролизе воды тепла, кДж/ч, равен:
где ∆V – напряжение разложения поваренной соли. При ί an = 200 А/м 2 , ∆V = 2,1 V.
Температура обрабатываемой воды 0 C в электролизе определяется из формулы:
где С – объемная теплоемкость воды, кДж/(л град.); q w – расчетный расход воды, м 3 /ч.
Видео:Батарея на отбеливателе. Увеличиваем площадь электродов и поднимаем ток к.з. в четыре раза!Скачать

Бытовые электрохимические реакторы
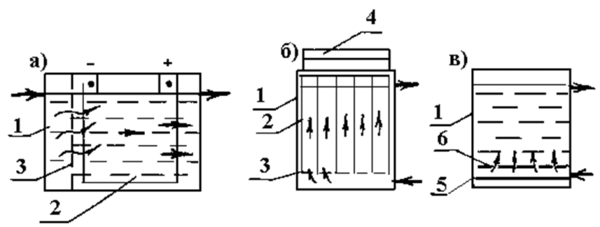
В бытовых условиях для электролиза воды чаще всего применяется дифрагменный проточный электрохимический реактор (СТЭЛ) [13], включающий электролизную ячейку, состоящую из катода и анода, разделенных специальной полупроницаемой мембраной (диафрагмой), разделяющую воду на щелочную фракцию — католит и кислую фракцию – анолит (рис. 12).
Рис. 12. Схема бытового электролизера для получения электроактивированных растворов воды. В результате катодной (католит) обработки вода приобретает щёлочную реакцию: её ОВП снижается, уменьшается поверхностное натяжение, снижается количество растворённого в воде кислорода, возрастает концентрация водорода, гидроксильных ионов (ОН — ), уменьшается электропроводность воды, изменяется структура не только гидратных оболочек ионов, но и самой воды [14]. По внешним характеристикам католит – мягкая, светлая, с щелочным привкусом вода, иногда с белым осадком; её рН = 10-11 ед, ОВП = -200 – -800 мВ.
По физико-химическим параметрам католит является раствором с заметно усиленными электронодонорными свойствами и, попадая в физиологические жидкости организма способен усиливать электронодонорный фон на несколько десятков милливольт [15]. Антибактериальное действие католита диффренцированное: бактерицидный эффект проявляется относительно энтеробактерий, устойчивыми к нему являются энтерококки и стрептококки группы В, а в отношении грамотрицательных микроорганизмов — только бактериостатическое [16].
Электрохимически активированные растворы католита, в зависимости от силы пропускаемого тока могут быть нескольких видов:
К — католит щелочной (рН > 9, ОВП = 700-820 мВ), активные компоненты NaOH, О 2, НО 2 — , НО 2* · , ОН — , ОН*, НО 2 — , О 2;
КН— католит нейтральный (рН = 9, ОВП = 300-500 мВ), активные компоненты О 2, НО 2 — , НО 2*, Н 2О 2, Н + , ОН — .
При анодной (анолит) электрохимической обработке кислотность воды увеличивается, ОВП возрастает, несколько уменьшается поверхностное натяжение воды, увеличивается электропроводность, возрастает количество растворённого в воде кислорода, хлора, уменьшается концентрация водорода, изменяется структура воды [17]. По внешним признакам анолит— коричневатая, кисловатая, с характерным запахом и вкусом жидкость с рН = 4-5 ед и ОВП = +500+1100 мВ. По параметрам токсичности анолит при введении в желудок и нанесении на кожу относится к 4 классу малоопасных веществ по ГОСТ 12.1.007-76 и обладает в данном классе минимальной токсичностью. При ингаляционном введении анолит с содержанием оксидантов 0,02% и общей минерализацией 0,25-0,35% не оказывает раздражающего действия на органы дыхания и слизистые оболочки глаз. При введении внутрь анолит не оказывает иммунотоксического действия и повышения уровня хромосомных аберраций в клетках костного мозга и других тканях и не обладает цитогенетической активностью. При нагревании до 50 С бактерицидная активность анолита увеличивается на 30-100% [18].
Электрохимически активированные растворы анолита подразделяются на четыре основных типа:
А — анолит кислотный (рН 2, НСl, НО 2*;
АН -анолит нейтральный (рН = 6, ОВП = + 600-900 мВ), активные компоненты НСlО, О 3, НО — , НО 2*;
АНК — анолит нейтральный (рН = 7,7, ОВП = + 250-800 мВ), активные компоненты НСlО, СlО — , НО 2 — , Н 2О 2, О 2, Сl — , НО*;
АНД — анолит нейтральный (рН = 7,3, ОВП = +700-1100 мВ), активные компоненты НСlО, НСlО 2, СlО — , СlО 2*, НО 2*, Н 2О 2, О 2, О 3, Сl — , НО — , О*.
На основании материалов, опубликованных в сборника Второго и Третьего Международных симпозиумов «Электрохимическая активация в медицине, сельском хозяйстве, промышленности», монографии Прилуцкого В.И. и Бахира В.М. [19] приводятся следующие данные о некоторых свойствах и лечебном действии анолита и католита:
Анолит обладает антибактериальным, противовирусным, антимикозным, антиаллергическим, противовоспалительным, противоотёчным, противозудным и подсушивающим действием, может оказывать цитотоксическое и антиметаболическое действие, не причиняя вреда клеткам тканей человека. Биоцидные вещества в электрохимически активированном анолите, не являются токсичными для соматических клеток, поскольку представлены оксидантами, подобными тем, которые продуцируют клетки высших организмов.
Католит обладает антиоксидантными, иммуностимулирующими, детоксицирующими свойствами, нормализует ОВП, метаболические процессы (повышение синтеза АТФ, изменение активности ферментов), стимулирует регенерацию тканей, повышает синтез ДНК и стимулирует рост и деление клеток за счёт увеличения массопереноса ионов и молекул через мембраны, улучшает трофические процессы и кровообращение в тканях.
Растворы анолитов и католитов находят применение в медицине в качестве антисептиков с целью дезинфекции и стерилизации инструментов, помещений, аппаратуры, предметов ухода, кожи и слизистых и т.д., а также для лечения гнойных ран [20]. Использование смоченных в анолите салфеток позволяет за 3-5 дней очистить поверхность ран, флегмонов, абсцессов, трофических язв, гнойно-некротических поражениях подкожной клетчатки, а последующее наружное применение католита в течение 5-7 дней существенно ускоряет репаративные процессы в тканях. Имеются также данные о высокой лечебной эффективности электроактивированных растворов воды при гастритах, язвенной болезни желудка, уретритах, эрозии шейки матки, язвах роговицы, инфекционных заболеваниях кожи, при лечении стоматитов, парадонтитов, а также при сахарном диабете. Одним из положительных свойств электроактивированных растворов воды является их дешевизна (20 рублей за литр) и экологичность.
Электролиз воды находит все более широкое применение во многих отраслях промышленности и в быту, в том числе в водоподготовке и водоочистке. Отечественной промышленностью выпускаются бытовые установки для проведения электролиза воды “СТЭЛ”, “Эсперо-1”, “Гейзер”, “Биомед” и др. Электроактивированные растворы католитов и анолитов производятся в бутилированном виде и продаются в аптеках и магазинах. Однако, фармакологические исследования электроактивированных растворов воды, как лекарственных средств – их фармакологическое действие и токсичность изучены не достаточно. В РФ такие исследования проводятся, в основном, на кафедре фармакологии Воронежской медицинской академии.
Видео:ЭлектролизСкачать

Заключение
Электрохимическая обработка воды обладает рядом преимуществ по сравнению с альтернативными механическими, химическими и биологическими методами водообработки и водоочиски. Эти преимущества заключаются в эффективности, устойчивости, контролируемости и удобном автоматическом регулировании процессов, а также простоте конструкции аппаратуры. Установки для электрохимической очистки воды компактны, имеют высокий уровень безотказности, требуют простой эксплуатации и могут быть полностью автоматизированы. С другой стороны, при электрохимической обработке воды возрастает энергопотребление, а в случае применения растворимых анодов расходуется тонколистовая сталь. Поэтому электрохимическая обработка обычно оказывается более выгодной для установок малой производительности (до 10-20 м 3 /час). В многоступенчатых схемах улучшения качества воды электрохимическая обработка может удобно сочетаться с другими методами водоподготовки.
Видео:Токовый электролиз воды. Итоги, рекомендации, выводы | Водород-12Скачать

Литература
1.Бахир В.М., Лиакумович А.Г., Кирпичников П.А., Спектор Л.Е., Мамаджанов У.Д. “Физическая природа явлений активации веществ”, Изв. АН УзССР. Сер.техн. наук, 1, 60-64 (1983).
2. Кульский Л. А. Очистка воды электрокоагуляцией / Л.А. Кульский, П.П. Строкач, В.А. Слипченко и др., Будiвельник, Kiев (1978), 112 с.
3. Липовецкий Я.М. Электрохимические способы очистки питьевых и сточных вод / Я.М. Липовецкий, Я.Д. Рапопорт, ЦБНТИ Минжилкомхоза РСФСР, Москва (1985), 56 с.
4. Кирпичников П. А., Бахир В. М., Гамер П.У., Добреньков Г.А., Лиакумович А.Г., Фридман Б.С., Агаджанян С.И. “О природе электрохимической активации сред”, Докл. АН СССР, 286(3), 663-666 (1986).
5. Бахир В.М.,Задорожний Ю.Г. Электрохимические реакторы РПЭ, Гиперокс, Москва (1991), 35 c.
6. Яковлев С.В. Технология электрохимической очистки воды / С.В. Яковлев, И.Г. Краснобородько, В.М. Рогов. Л.О. Стройиздат, Ленинград (1987), 312 с.
7. Бахир В.М. Современные технические электрохимические системы для обеззараживания, очистки и активирования воды. ВНИИИМТ, Москва (1999), 84 с.
8. Бахир В.М., Задорожний Ю.Г., Леонов Б.И., Паничева С.А., Прилуцкий В.И. Электрохимическая активация: очистка воды и получение полезных растворов, ВНИИИМТ, Москва (2001), 176 с.
9. Кульский Л.А. Справочник по свойствам, методам анализа и очистке воды: В 2-х частях. Часть 1 / Л.А. Кульский, И.Т. Гороновский, А.М. Когановский и др., Наукова думка, Киев (1980), 680 с.
10. Медриш Г.Л. Обеззараживание природных и сточных вод с использованием электролиза / Г.Л. Медриш, А.А. Тайшева, Д.Л. Басин., Стройиздат, Москва (1982), 80 с.
11. Воловник Г.И. Теоретические основы очистки воды / Г.И. Воловник, Л.Д. Терехов. Часть 1., Издательство ДВГУПС, Хабаровск (2000), 167 с.
12. Бахир В. М. Электрохимическая активация, ВНИИИ мед. техники, 2 часть, Москва (1992), 657 c.
13. Бабцова Н.Ф., Комаров И.Ф. Опыт использования установки СТЭЛ в хирургическом отделении. Второй международный симпозиум. Электрохимическая активация. Тез. докладов и краткие сообщения. ч.1 (1999), с. 131-132.
14. Леонов Б.И., Прилуцкий В.И., Бахир В.М. Физико-химические аспекты биологического действия электрохимически активированной воды, ВНИИИМТ, Москва (1999), 244 с.
15. Бахир В.М. Теоретические аспекты электрохимической активации. / Второй международный симпозиум. Электрохимическая активация. Тез. докладов и краткие сообщения, ч.1 (1999), с.39-49.
16. Торопков В.В., Альтшуль Э.Б., Торопкова Е.В. Токсикологическая характеристика препарата католит / Третий Международный симпозиум «Электрохимическая активация»// Доклады и краткие сообщения, Москва (2001), с.57-62.
17. Леонов Б.И., Бахир В.М., Вторенко В.И. Электрохимическая активация в практической медицине / Второй Международный симпозиум «Электрохимическая активация»// Тез. докл. и краткие сообщения, ч.1, Москва (1999), с.15-23.
18. Торопков В.В.Альтшуль Э.Б., Пересыпкин О.И. Фармакологическая эффективность действия анолитов АН и АНК на слизистые оболочки ротовой полости / Второй Международный симпозиум «Электрохимическая активация»// Тез. докл. и краткие сообщения, ч.1, Москва (1999), с. 93-95.
19. Прилуцкий В.И., Бахир В.М. Электрохимически активированная вода: аномальные свойства, механизм биологического действия, ВНИИИМТ, Москва (1997), 228 с.
20. Паничева С.А. Новые технологии дезинфекции и стерилизации сложных изделий медицинского назначения, ВНИИИМТ, Москва (1998), 122 с.
Видео:Электролиз. Часть 1. Процесс электролиза, основные закономерности.Скачать

Технологический расчет установок электрокоагуляции воды
Очистка промышленных сточных вод методом электрокоагуляции основана на электролизе с использованием металлических (стальных или алюминиевых) анодов, подвергающихся электролитическому растворению под воздействием электрического поля. Метод электрокоагуляции технологически достаточно прост и эффективен — его используют для удаления из сточных вод неорганических и органических загрязнений — тяжелых металлов, хроматов, фосфатов, тонко диспергированных примесей, эмульгированных масел, жиров и масел и нефтепродуктов, органических взвесей и т.д.
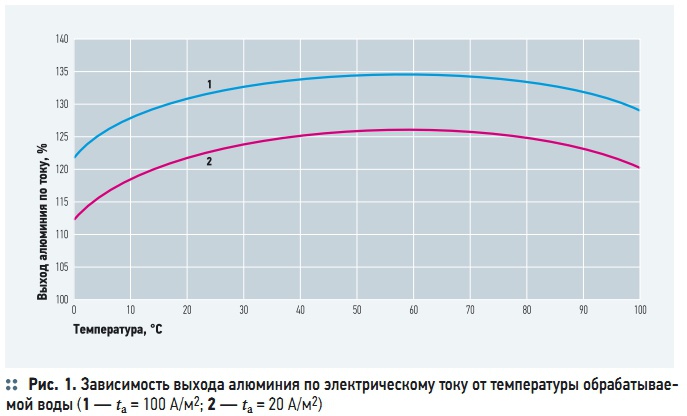
Рис. 1. Зависимость выхода алюминия по электрическому току от температуры обрабатываемой воды
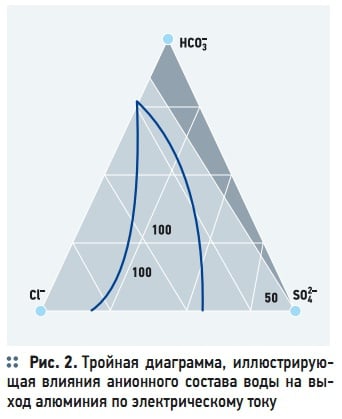
Рис. 2. Тройная диаграмма, иллюстрирующая влияния анионного состава воды на выход алюминия по электрическому току
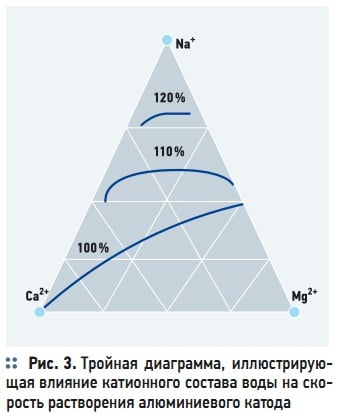
Рис. 3. Тройная диаграмма, иллюстрирующая влияние катионного состава воды на скорость растворения алюминиевого катода
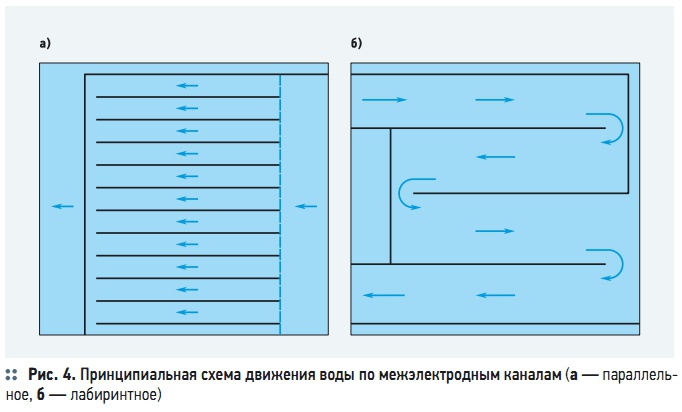
Рис. 4. Принципиальная схема движения воды по межэлектродным каналам
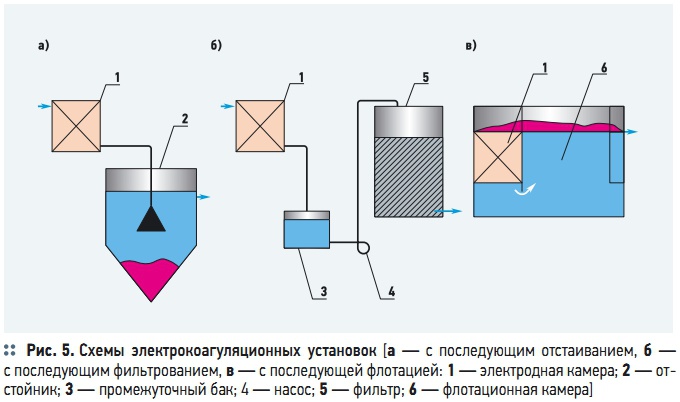
Рис. 5. Схемы электрокоагуляционных установок
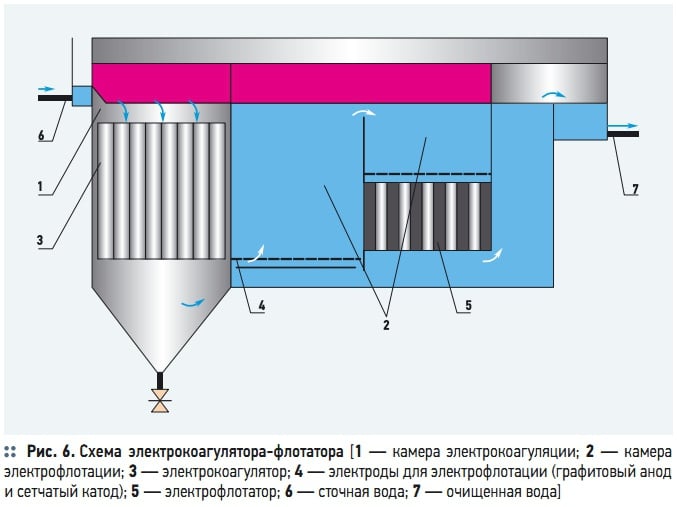
Рис. 6. Схема электрокоагулятора-флотатора
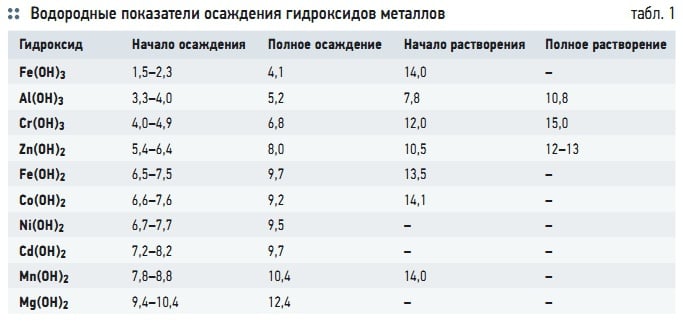
Табл. 1. Водородные показатели осаждения гидроксидов металлов
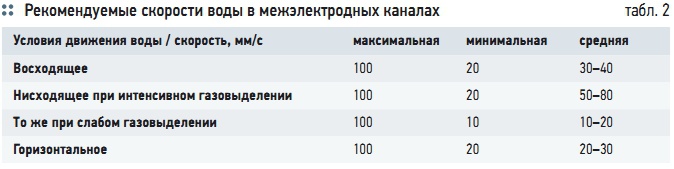
Табл. 2. Рекомендуемые скорости воды в межэлектродных каналах
Общие сведения
Электрокоагуляция — коагуляция (оседание) высокодисперсных коллоидных частиц и взвесей в виде гидроокисей металлов (алюминий, железо), генерируемых электрическим током за счет растворения металла анода (алюминиевого или железного) и воздействия постоянного электрического тока, который вызывает электролитическую диссоциацию растворенных в воде солей, а также селективное взаимодействие образующихся ионов с образованием и выпадением в осадок в виде нерастворимых гелей. Вследствие растворения анодов вода обогащается соответствующими катионами металлов, образующими затем в нейтральной и слабощелочной среде гидроокисью алюминия или гидрозакисью железа, которая под воздействием растворенного в воде кислорода переходит в гидроокись железа. Гидроокиси металлов обладают повышенной коагуляционной активностью и сорбционной способностью, что обеспечивает эффективную коагуляцию дисперсных примесей с участием продуктов электролиза.
Современная очистка сточных вод методом электрокоагуляции применяется на предприятиях машиностроительной и металлургической промышленности, где отработанная вода характеризуется высоким уровнем содержания солей тяжелых металлов, нерастворимых осадков, технических масел и нефтепродуктов. Электрокоагуляцию также можно применять для осветления и обесцвечивания воды, удаления из нее железа, кремния, хрома, СПАВ и радиоактивных веществ, а также для очистки воды от биологических загрязнений.
Наряду с электрокоагуляцией при наложении электрического поля происходит также: электролиз воды; поляризация коллоидных частиц; движение заряженных частиц в электрическом поле (электрофорез); окислительно-восстановительные процессы; химические реакции между ионами Аl 3+ или Fe2+, образующимися при электролитическом растворении металлических анодов и некоторыми содержащимися в воде ионами (S2 – , РO4 3– ); взаимодействие продуктов электролиза друг с другом; флотация твердых частиц пузырьками газообразного водорода, выделяющегося на катоде; сорбция ионов и молекул растворенных примесей на поверхности гидроксидов железа и алюминия, обладающих значительной сорбционной способностью [1].
Различают электростатическую, электрохимическую и гальваническую коагуляцию. Электростатическая коагуляция протекает за счет поляризации коллоидных частиц под влиянием внешнего электрического поля и слипания образовавшихся диполей. При этом возможно применение как постоянного поля, так и пульсирующего и знакопеременного. Для электростатической коагуляции требуются очень большие напряженности электрического поля, около 10–30 кВ/м, поэтому этот метод в водообработке сточных вод используется мало. Разновидностью электростатической можно считать электроконтактную коагуляцию, которая возникает при фильтровании воды в электрическом поле. В этом случае возможна частичная поляризация гидратированных ионов и коллоидных частиц под действием электрического поля с последующей коагуляцией диполей. Однако необходимые для коагуляции коллоидных частиц напряженности электрического поля очень велики, и этот способ применяется, в основном, для очистки обессоленных вод.
Электрохимическая коагуляция протекает за счет электролиза воды и изменения значения рН и окислительновосстановительного потенциала в объеме воды вблизи электродов. Электролиз производится с нерастворимыми электродами при электрическом напряжении на электродах, превышающем потенциал разложения воды (1,22 В).
Гальваническая электрокоагуляция протекает за счет электрохимического растворения в воде металлических электродов. В качестве материала электродов используют алюминий или сталь.
Механизм электрокоагуляции последовательно включает в себя следующие стадии: электрофоретическое концентрирование (направленное движение заряженных частиц примесей и концентрирование их у поверхности электродов); растворение электрода и образование гидроокисей металлов; поляризационная коагуляция дисперсных частиц; упаковка первичных агрегатов по мере накопления частиц гидроокисей; флокуляционная коагуляция; флотация образовавшихся агрегатов пузырьками газов [2].
На процесс электрокоагуляции оказывает влияние материал электродов, расстояние между ними, скорость движения сточной воды между электродами, ее температура и солевой состав, напряжение, сила и плотность электрического тока. С повышением концентрации взвешенных веществ более 100 мг/л эффективность электрокоагуляции снижается. С уменьшением расстояния между электродами расход энергии на анодное растворение металла уменьшается. Теоретический расход электроэнергии для растворения 1 г железа составляет 2,9 Вт⋅ч, а 1 г алюминия — 2 Вт⋅ч.
Степень использования металла электродов составляет 50–90 % и зависит от конструкции коагуляторов, материала анода и состава обрабатываемой воды.
Электрокоагуляцию рекомендуется проводить в нейтральной или слабощелочной среде содержащей не менее 20 % хлористых солей (от общего солесодержания) и не более 75 % гидрокарбонатов и сульфатов, вызывающих пассивацию электродов, при плотности электрического тока не более 10 А/м 2 , расстояния между электродами не должны превышать 20 мм, а скорости движения воды — не менее 0,5 м/с.
При наличии в воде больших количеств катионов Са 2+ и Mg 2+ и невозможности добавления к ней хлоридов в качестве катодного материала следует использовать нержавеющую сталь и не производить смену полярности электродов. Продолжительность электрообработки воды определяется свойствами загрязнений и в среднем может изменяться в пределах одной-пяти минут. Учитывая малое расстояние между электродами и возможность засорения электродного пространства, сточные воды перед электрокоагуляцией целесообразно подвергать механической сорбции от крупно диспергированных загрязнений.
Процессы при электрокоагуляции
Главной лимитирующей стадией электрокоагуляции является образование катионов металлов — результат электрохимического растворения металлических анодов в соответствии с уравнением:
где М — символ металла; n — его валентность. На алюминиевых анодах протекает следующая реакция:
Al → Al 3+ + 3 e– , (2)
а на анодах из стали идет реакция:
Fe → Fe 2+ + 2e – , (3)
при этом часть катионов железа окисляется под действием растворенного в воде кислорода у анода до трехвалентного железа (III):
Fe 2+ → Fe 3+ + e – . (4)
Второй этап коагуляции сводится к химической гидратации образующихся катионов металлов, образовании нерастворимых гидроксидов металлов, их выпадении в осадок (кристаллизации) с последующим формированием хлопьев, способных флокулировать грубодисперсные примеси воды. Соответствующие химические реакции происходят в межэлектродном пространстве и включают несколько этапов:
Al 3+ + 3 OH → Al(OH) 3+ , (5)
Fe 3+ + 3 OH → Fe(OH) 3+ , (6)
Fe 2+ + 2 OH → Fe(OH) 2+ , (7)
В результате поступления в воду необходимого количества катионов железа или алюминия за счет приведенных выше реакций возникает та же ситуация, что и при обработке воды коагулянтами: солями железа или алюминия. Однако в отличие от применения солевых коагулянтов при электрокоагуляции вода не обогащается сульфатами или хлоридами, содержание которых в очищенной воде лимитируется как при сбросе ее в водоемы, так и при повторном использовании в системах промышленного водоснабжения.
Образование в воде многовалентных катионов понижает устойчивость отрицательно заряженных коллоидов, так как уменьшается толщина диффузионного слоя коллоидной частицы и понижается ее потенциал [3]. Устойчивость (стабильность) коллоидов обусловлена взаимодействием межмолекулярных сил взаимного притяжения и отталкивания, возникающих на границе соприкосновения двойных электрических слоев (ДЭС) сблизившихся частиц:
где U1 и U2 — соответственно силы отталкивания и притяжения. Если ΔU ≥ 0, укрупнение частиц невозможно, если ΔU ≤ 0 — произойдет слипание частиц, то есть коагуляция.
В электрическом поле создаются особенно благоприятные условия для коагуляции, чему способствует дополнительно возникающая сила диполь-дипольного воздействия U3, уменьшающего ДЭС и поляризующего коллоидные частицы:
Процесс коагуляции в электрокоагуляторах протекает значительно интенсивнее, чем при реагентной коагуляции, что объясняется положительным влиянием электрофореза на взаимное укрупнение зародышей частиц гидроксидов металлов и перемешиванием воды выделяющимися на катодах пузырьками водорода. Благоприятные условия электрокоагуляции позволяют уменьшить дозы металла, необходимые для очистки, по сравнению с дозами при реагентной коагуляции на 10–20 % и более.
Помимо использования электрокоагуляции для дестабилизации коллоидов и флокуляции грубодисперсных примесей, этот метод применим в схемах очистки воды от катионов тяжелых металлов. Это становится возможным в результате повышения значения рН воды (от 2,3 до 10,4) при электролизе, когда металлы переходят в состояние нерастворимых гидроксидов и осаждаются совместно с гидроксидами железа [4]. Значения водородных показателей, необходимых для осаждения тяжелых металлов, приведены в табл. 1. Значения рН зависят от концентрации осажденного иона. Большие значения рН относятся к меньшим концентрациям. Если при электролизе повышение рН оказывается недостаточным, необходимо увеличить водородный показатель воды перед электролизером путем подщелачивания за счет добавления в обрабатываемую воду щелочи.
Электрохимическое растворение металлов включает анодное растворение за счет внешнего электрического тока и химическое растворение анодов и катодов. Поэтому на практике выход металлов G по электрическому току может оказаться больше теоретически рассчитанного по формуле (11), определяемой законами Фарадея, и может составлять 120–130 % от теоретического выхода:
где А — электрохимический эквивалент элемента: A = M/(26,8z) г/(А⋅ч); z — валентность; Icur — сила тока, А; τ — время обработки, ч.
Основными факторами, влияющими на электрохимическое растворение анода, являются: температура, сила и плотность электрического тока, значение рН, солевой состав воды, расстояние между электродами, скорость движения воды между электродами, концентрация взвешенных веществ. Повышение температуры воды при электрокоагуляции увеличивает выход металла по току, так как при этом интенсифицируются химические реакции, в том числе растворения металлов. Однако, как видно из рис. 1, положительное влияние роста температур наблюдается только до достижения некоторого температурного максимума (60– 80 °C), а дальнейшее повышение температуры снижает выход металла. В работе [5] это объясняется возрастающей интенсивностью пассивации алюминиевого анода за счет уплотнения и набухания коллоидальной гидроокиси алюминия в его микропорах.
Существенное влияние на соотношении количества металла, растворяемого электрохимическим и химическим путем, оказывает и значение рН. При рН = 6–8 в результате электрохимического процесса растворяется до 90 % алюминиевых анодов. Химическим способом растворяется около 70 % металла при рН = 6–8, в том числе 50 % при растворении катода. Суммарный выход алюминия по электрическому току возрастает в слабокислой и особенно щелочной среде, достигая 150–200 % [6]. Влияние водородного показателя на процесс растворения электродов связано с растворением пассивирующих отложений (табл. 1).
Влияние анионного состава водной среды на растворение анодов главным образом обусловлено условиями пассивации. Эффективным депассивантом является анион хлора (анодная поляризация). На рис. 2 показана диаграмма, иллюстрирующая роль основных анионов в процессе растворения алюминиевых электродов по выходу алюминия. Вершины треугольной диаграммы соответствуют 100 % содержанию трех основных анионов: хлор (Cl – ) – , сульфат (SO4 2+ ) — и гидрокарбонат (HCO3 – ) — аниона. С уменьшением процентного содержания хлориона в водной среде выход алюминия по току уменьшается. На графике заштрихована критическая область возрастающей пассивации анода, в пределах которой анод становится практически нерастворимым (рис. 2).
На процесс химического растворения катода также влияет катионный состав водной среды. Диаграмма, иллюстрирующая влияние основных катионов — натрия, кальция и магния на химическое растворение алюминиевого катода приведена на рис. 3. Катионы натрия оказывают депассивирующее воздействие на катод. Напротив, катионы магния и особенно кальций, усиливают пассивацию катода (рис. 3). Другим фактором, оказывающим положительное влияние на выход катионов металлов, является плотность электрического тока, А/м 2 :
где I — величина электрического тока при электролизе, А; Fэл — площадь анода или катода, м 2 .
Оптимальными принимаются плотности электрического тока: для алюминиевых электродов, катодная плотность — tк = 10–35 А/м 2 , анодная — tа = 20–150 A/м 2 , а для железных электродов tа = tк = 10–100 A/м 2 . При плотности тока более 200 А/м 2 растворение электродов сопровождается заметной электрофлотацией и усилением пассивации электродов. Периодическое переключение полюсов способствует депассивации электродов, что интенсифицирует их химическое растворение. Экспериментально установлено, что максимальный выход алюминия по току достигается при переключении полюсов через каждые 15 минут, то есть четыре раза в час [7]. На выход металла по току влияет и схема соединения электродов, при этом наибольший выход — при монополярном соединении.
Конструкции электрокоагуляторов
Электрокоагуляция осуществляется в специальных генерирующих катионы металла (чаще всего алюминия и железа) электрических приборах — электрокоагуляторах (рис. 4–5). Основной элемент электрокоагулятора — электродная камера со сменным набором стальных или алюминиевых (дюралюминиевых) электродов чередующейся полярности, в зазорах между которыми (шириной 5–20 мм) протекает обрабатываемая вода со скоростью не менее 0,5 м/с. Как и в электролизерах, в электрокоагуляторах электроды могут располагаться горизонтально или вертикально с зазором 10–16 мм, что зависит от условий размещения и монтажа, а также от расходов обрабатываемой воды. В электрокоагуляторах с меньшими плотностями электрического тока в связи с незначительным пенообразованием можно принимать ширину межэлектродных каналов менее 15 мм, и при обосновании не предусматривать устройств для удаления пены. При больших плотностях электрического тока ширина межэлектродных каналов должна принимается не менее 15–20 мм. Для удаления скоплений пены в каналах предусматриваются различные устройства, в частности, продувка сжатым воздухом.
Аноды и катоды выполняются в виде пластин из алюминия, его сплавов, не содержащих медь, или стали. Подключение пластин к источнику тока может быть параллельным или последовательным. В первом случае все электроды действуют как монополярные, во втором — промежуточные пластины работают биполярно. Последовательное же подключение позволяет работать при меньших значениях электрического тока. Наряду с пластинчатыми иногда используют засыпные электроды из стальной стружки. Несмотря на некоторые преимущества (большая поверхность, низкая стоимость), засыпные электроды применяются редко, поскольку они засоряются гидроксидами металлов и плохо регенерируются. Выбор материала для электродов зависит от технологических особенностей процессов очистки.
Если для коагуляции можно применить и алюминий и железо, выбор материала обосновывается технико-экономическими соображениями. Для коагуляции требуются большие дозы железа, чем алюминия, но для растворения 1 г железа затрачивается меньше электроэнергии. Теоретически, при расходе электроэнергии 26,8 А/ч в раствор переходит около 9 г металлического алюминия или же 28 г железа.
При низкой плотности тока необходимо увеличить необходимую продолжительность пребывания обрабатываемой воды в межэлектродном пространстве, ведь растворение анодов и хлопьеобразование протекают незначительно. Увеличение продолжительности пребывания воды достигается за счет увеличения длины межэлектродных каналов последовательным размещением электродных блоков по ходу движения воды или за счет ее рециркуляции. Для удлинения межэлектродных каналов их часто выполняют не по параллельной, а по последовательной (лабиринтной) схеме (рис. 4б).
Поскольку в результате объемных электрохимических процессов в межэлектродном пространстве формируются хлопья гидроокисей металлов, для их удаления устанавливают блок последующей очистки (отстойник, фильтр большой грязеемкости, флотатор), показанный на рис. 5. Электрокоагуляторы, работающие при низкой плотности электротока (менее 18–20 А/м 2 ), целесообразно применять по схемам на рис. 5а и 5б, совместно с отстойниками и фильтрами большей грязеемкости. При более высоких плотностях электрического тока рекомендуется применять схему с флотатором (рис. 5в).
Блоки, состоящие из электрокоагулятора и флотационной камеры, называются электрофлотокоагуляторами (ЭКФ). Компоновка ЭКФ может предусматривать размещение электрокоагулятора в пределах флотационной камеры, и раздельно. Типовая конструкция, например, ЭКФ [8] имеет прямоугольную форму и состоит из трех отсеков: в первом отсеке размещается электрокоагулятор, во втором — электрофлотатор, третий отсек является отстойной камерой. Электроды, размещаемые в третьей секции, служат для обеззараживания воды (рис. 6).
Конструкцию электрокоагулятора следует выполнять с учетом условий замены электродов в случае их растворения, для очистки и депассивации. С целью интенсификации процесса электрокоагуляции может использоваться конструкция виброэлектрокоагулятора. Применение вибрационных колебаний среднего диапазона частот практически исключает пассивацию электродов, снимает диффузионные ограничения во всем рабочем объеме, облегчает удаление газов и образующихся осадков, выгружаемых периодически через специальный клапан без остановки аппарата.
Расчет электрокоагулятора
Производительность электрокоагулятора по количеству генерируемого растворенного металла является весьма важной расчетной величиной и должна соответствовать технологическим требованиям процесса электрохимической обработки воды.
Приведем последовательность расчета электрокоагулятора, предложенную Г. И. Воловником и М. И. Коробко [9]. Сначала вычисляется количество растворенного металла [г] при электрохимическом разложении электродов:
где Дм — доза металла, г/м 3 ; qw — расчетная производительность электрокоагулятора, м 3 /ч; τ — период времени (принимается 1 час).
Дозы металла, необходимые для электрокоагуляции, определяются экспериментально. Ориентировочно можно принимать значения доз коагулянтов, известные из опыта реагентной обработки коагулянтами аналогичной по качеству воды, с введением коэффициента пересчета. Коэффициент должен учитывать повышенную эффективность электрокоагуляции, вид коагулянта, и приниматься равным 0,85–0,90. Пересчет с целью определения доз металлов по принятой дозе реагента производится путем умножения последней на коэффициент, который равен для Al2(SO4)3 — 0,158, для Al2O3 — 0,53, FeCl3 — 0,34, Fe2(SO4)3 — 0,28. Например, если для коагуляции природной воды с мутностью 200 г/м 3 доза сернокислого алюминия равна 40 г/м 3 , то доза алюминия при электрокоагуляции составит величину:
40 × 0,85 × 0,158 = 5,4 г/м 3 .
Дозы металлического алюминия [мг/л], необходимые при электрокоагуляционном обесцвечивании воды, ориентировочно могут определяться путем корректировки формулы СНиП [10]:
где Дм — доза коагулянта по Al2O3, г/м 3 ; Ц — цветность исходной воды, град.
В результате одновременного растворения электродов расчетным электрохимическим и дополнительным химическим путями выход металла по току превышает 100 %, что учитывается введением повышающего коэффициента Км > 1 (по условиям процесса Км = 1,1–2,0, определяется экспериментально).
Расчетная производительность электрокоагулятора по металлу [г] определяется по формуле:
где η — коэффициент использования тока, принимается равным 0,7–0,9; Ам — электрохимический эквивалент металла, г/(А⋅ч) [11]. На основании формулы (15) сила тока [А], необходимая для генерации расчетного количества металла:
Площадь анодов [м 2 ] вычисляется:
где плотность анодного тока tан принимается равной 20–150 А/м 2 . Напряжения в электродной ячейке принимаются не менее 3 В для стальных и 4 В — для алюминиевых электродов.
По расчетной силе тока определяется общая площадь [м 2 ] поверхности электродов составит:
где ιкат — катодная плотность тока, А/м 2 . Площадь одной пластины (электрода), измеряемая в [м 2 ], рассчитывается по следующей формуле:
где lпл и bпл — длина и ширина пластины, соответственно, м. Площади анодов и катодов принимаются одинаковыми, а количество пластин в электродной камере [шт.] рассчитывается по формуле:
Поскольку металлы генерируются у анода, в расчетах используется анодная плотность тока tан, которая задается экспериментально, в зависимости от продолжительности процесса электролиза при постоянном эффекте очистки воды, в пределах величины 100–300 А/м 2 [12]. Минимальная ширина межэлектродных каналов равна:
Ширина межэлектродных каналов принимается равной Δ = 0,015–0,02 м.
Вместимость межэлектродного пространства [м 3 ] рассчитывается по формуле (22), и должна обеспечивать пребывание в них воды в течение промежутка времени τ1 ≥ 20–30 с:
В случаях, когда вместимость оказывается чрезмерно большой, предусматривается система с циркуляцией для поддержания требуемой скорости воды в межэлектродных каналах.
Производительность всего рециркулятора должна быть равна следующей величине, м 3 /ч:
где τ1 — расчетная продолжительность пребывания воды в межэлектродном пространстве, ч.
Скорость воды в межэлектродных каналах составит величину, мм/с:
Эта скорость должна быть достаточной для поддержания во взвешенном состоянии хлопьев гидроксидов металлов. Рекомендуемые скорости воды в межэлектродных каналах [13] приведены в табл. 2. Если вместимость межэлектродного пространства недостаточна для требуемой продолжительности пребывания воды в зоне электролиза, применяется установка периодического действия.
Необходимая продолжительность электролиза обеспечивается многократным пропуском воды через имеющийся электролизер. Число таких пропусков определится как:
При проектировании электрокоагулятора-флотатора также необходимо рассчитать достаточное количество выделяемого при электролизе воды газообразного водорода по условиям флотации. Расчетное количество выделяемого водорода [л/кг] определяется по формуле:
где qуд н — удельное потребление водорода, требуемое для извлечения единицы массы загрязнений, л/кг; К — понижающий коэффициент, который учитывает интенсификацию процесса агрегации газовых флокул при электролизе, К = 0,7–0,8; Сen — концентрация загрязнения в исходной воде, мг/л; Э — принятый в расчете эффект очистки, доли ед.; qw — удельное потребление воды, л/кг. Фактическое количество выделяемого водорода:
0,4Icur, (27) где Icur — cила электрического тока, А. Эта зависимость получена путем преобразования формулы:
Если количество выделяющегося водорода оказывается недостаточным, то дополнительно предусматривается установка блока нерастворимых электродов, которые размещаются после блока для электрокоагуляции непосредственно в корпусе электрокоагулятора или камеры флотации. Дополнительный электродный блок рассчитывается на генерирование количества водорода:
Концентрация загрязнений в воде определяется по формуле, мг/л:
где Сen — содержание грубодисперсных примесей в исходной воде, мг/л; ΔС — содержание в воде продуктов электрокоагуляции, мг/л:
где Км — коэффициент пересчета содержания гидроокисей на твердую массу осадка согласно химическим реакциям гидратообразования. Для алюминия Км = 2,89, для трехвалентного железа — 1,91, для двухвалентного железа — 1,62.
Эксплуатационный расчет установок
Эксплуатационные работы включают: усреднение по расходам и качеству воды, поступающей в электрокоагулятор; корректировку качества воды (очистка от грубодисперсных примесей, корректировка рН и солевого состава); поддержание расчетного режима рециркуляции воды в контуре электрокоагулятора, если это предусмотрено схемой обработки; контроль значений и поддержание на нужном уровне электрических параметров — силы тока, напряжения; соблюдение режима переполюсовок электродов для депассивации и способа равномерного растворения всех электродов; очистку межэлектродного пространства от отложений и пены; удаление образующейся при электролизе пены; своевременную замену электродов; контроль за состоянием газовой среды и обеспечение эффективной работы системы вентиляции; правильное содержание сооружений для последующей очистки воды (отстойники, флотаторы, фильтры).
Продолжительность периода использования электродов (рабочего цикла) принимается в пределах 500–1000 ч:
где Gпл — масса электродных пластин, кг; Дм — доза металла, г/м 3 ; Кисп — коэффициент использования электродов (обычно принимается 0,8–0,9).
Общая масса электродных пластин:
где Σf — суммарная площадь поверхностей анода и катода, м 2 ; d1 и d2 — толщины пластин соответственно анодов и катодов, м; γ1 и γ2 — плотности материалов анодов и катодов, соответственно (железа — 7600, титана — 4500, алюминия — 2700, графитизированного угля и графита — 2100 кг/м3). Рекомендуемые параметры электрокоагуляторов: материал электродов — алюминий или железо; расстояние между вертикально устанавливаемыми пластинами электродов — 15–20 мм; электрическое напряжение на электродах — 6 В; плотность тока — 30/40 А/м 2 для алюминиевых/стальных электродов; продолжительность пребывания воды в межэлектродном пространстве — 3–5 мин.; доза железа и алюминия составляет 15 и 7 г/м 3 .
Заключение
Основными преимуществами электрокоагуляционного метода по сравнению с реагентными являются компактность установки, относительная простота ее эксплуатации и резкое сокращение расходов на химические реагенты. Наряду с электрокоагуляцией также происходит и бактерицидная обработка воды.
Недостатками является расход металла (алюминия и железа) и электроэнергии. Теоретически, для растворения 1 г железа и 1 г алюминия расходуется 3 и 12 Вт⋅ч, соответственно. Фактический же расход электроэнергии оказывается выше из-за затрат на нагревание воды, поляризацию электродов, преодоление электрического сопротивления оксидных пленок, образующихся на поверхности растворяемых анодов, и т.п.
Для осуществления электрокоагуляции требуются значительные затраты электроэнергии и листовой металл, поэтому ее можно рекомендовать для локальных схем очистки небольших количеств сточных вод (50–80 м 3 /ч). Электрокоагуляция эффективна для удаления из сточных вод тонко диспергированных примесей, эмульсий, масел и нефтепродуктов, органических взвесей и т.д. Рекомендуется применять этот метод для очистки сточных вод с нейтральной или слабощелочной реакцией (pH = 6–9).
Видео:Магнитный Электролиз 2Скачать

Электролиз воды с индуктивного напряжения импульсов
[1] Институт физики твердого тела Латвийского университета, Рига, Латвия
Видео:Некоторые параметры импульсного электролиза. H2-15Скачать

1. Введение
Основная идея водородной экономике является создание моста между энергоресурсов, производителями и потребителями энергии. Если водород производится из возобновляемых источников энергии (ветра, солнца, гидро-, биомассы и т.д.), и используется для производства энергии в процессе каталитического горения, то жизненная энергия цикл не загрязняет природу больше. С переходом на водородной экономике общество будет жить в соответствии с к модели устойчивого развития, определенного в 1987 ( Наше общее будущее, 1987 ).
Водород не доступен на Земле в свободной форме; Поэтому производственный процесс, представляющий большую часть конечной цены водорода ( водород Pathway, 2011 ). Это является основной причиной, пока исследования эффективных методов электролиза является очень актуальной. На нашей планете водород в основном расположены в таких соединений, как углеводороды, воду и т.д. и соответствующий энергии необходимо выпустить водород из них. В принципе количество потребляемой энергии всегда больше, чем то, что можно извлечь из водорода, а в реальных условиях эксплуатации, эффективность цикла не превышает 50% ( водородной экономики, 2004 ). Текущая проблема мотивируется искать улучшения существующих и открытия новых технологий для получения водорода из воды — широко доступный и возобновляемый источник на Земле.
Электролиз воды известен более 130 лет уже, и различные технологии разрабатываются давая Потребляемая мощность около 3,6 кВт / м 3 — высокая температура электролиза, и 4,1 кВт / м 3 — комнатная температура щелочные электролизеры и протонной обменной мембраной электролизеры ( водородной экономики, 2004 ). Снижение издержек производства водорода для технологий с использованием закрытых термохимических циклов, но только в тех местах, где огромное количество отработанного тепла доступно (например, атомные электростанции ( водородной экономики, 2004 ). Тем не менее то, что будет сегодня быть цена водорода, в будущем только водород, полученный из возобновляемых ресурсов с помощью электричества из возобновляемых источников энергии спасет мир, как было заявлено, в второй Всемирной водорода Конгресса в Турции ( Избранные статьи 2009 ). Для Латвии водород, полученный при электролизе с использованием электроэнергии из возобновляемых источников энергии (ветер , Солнце, вода) также будет лучшим решением, чтобы перейти к водородной экономике ( Dimants ET все 2011 ). Это потому, что все возобновляемые источники энергии, доступные в географическое положение Латвии дают не-стабильной и прервать питание, для которых решения хранения необходимы . Использование водорода в качестве энергоносителя будет производиться от электроэнергии, вырабатываемой возобновляемых источников энергии, сохраняются и после используется в батареи топливных элементов для выработки электроэнергии является лучшим решением ( Zoulias, 2002 ). Эффективные и стабильные электролизеры необходимы для таких целей. Меньшие единицы электролиза необходимы также для технических решений были водород производится и используется непосредственно по запросу, например, сварочные водорода устройства, на водородном топливе внутренние автомобили сгорания ( Kreuter и Hofmann, 1998 ).
Питания постоянного тока, как правило, используется для электролиза, тем не менее импульс подачи питания также предлагается (см., например, Gutmman и Murphy, 1983 ). Использование механически прерван источник питания постоянного тока (Brockris и Поттер, 1952; все Бокриса др., 1957 ) рядом интересных явлений было замечено: сразу после подачи напряжения на электрохимической системе, наблюдалось высокой, но недолго ток всплеск. Когда приложенное напряжение было отсоединить, значительный ток продолжает течь в течение короткого времени. В 1984 Ghoroghchian и Бокриса разработали униполярный генератор ездить электролизер на импульсного напряжения постоянного тока. Они пришли к выводу, что скорость производства водорода будет почти вдвое больше, чем ставка для постоянного тока.
Латвийская Водород Исследовательская группа разрабатывает индуктивный датчик импульсов силовых цепей для воды электролизера ( Ванагс и др. все 2009 , 2011a , 2011b ). Исследования показали, несколько существенных различий по сравнению с обычным DC электролиза воды. Новая модель создается и описаны, а также гипотеза установлено, что молекула воды можно разделить на водород и кислород на одном электроде ( Vanags др. концов, 2011a ). Там было обнаружено и объяснил принцип высокой эффективности электролиза. Новый тип схемы электроснабжения на основе генератора импульсов напряжения индуктивный предназначен для электролиза воды. Газов, выделяющихся при процессе электролиза из электродов впервые анализируются количественно и качественно с использованием микросенсоров (растворенных газов в растворе электролита соседнем электрода) и masspectrometer (в атмосфере превратилась газов). Гипотеза водорода и выделения кислорода на катоде в процессе импульсного электролиза является оригинальной, а также интерпретация процесса с механизмами релаксации электронов, испускаемых катодом и сольватированными в электролите ( Ванагс, 2011b ).
Видео:Магнитный электролиз (Magnetic electrolysis) © SEVER-SСкачать

2. Обзор литературы
2.1. КРАТКАЯ ИСТОРИЯ ЭЛЕКТРОЛИЗА ВОДЫ
Адриан Paets ван Troostwijk, 1752.-1837., И Йохан Рудольф Deiman, 1743.-1808., В то время как с помощью лейденской банки и мощный электростатический генератор заметил выделение газа на электродах воды электролизера в результате искры overjumping в электростатический генератор. В выделяемые газы перемещенных воду из лейденской банки во время эксперимента и искры прыгнул в собранной газовой смеси создания взрыв. Исследователи решили, что они разлагают воду на водород и кислород в стехиометрическом соотношении 2:01; они опубликовали результаты в 1789 году, который считается годом открытия электролиза воды ( Zoulias ET все, 2002 ; De Levie, 1999 ). В более что сто лет, в 1902 году насчитывалось более 400 промышленных электролизеров, используемые во всем мире, но в 1939 году первое крупное воды электролизный завод был введен в эксплуатацию с производства водорода мощностью 10 000 Нм 3 / ч ( Zoulias др. все, 2002 ) . Электролизеров высокого давления были произведены в 1948 впервые; в 1966 году General Electric построила первый систему электролиза с твердым электролитом и в 1972 году был построен первый твердый оксид высокотемпературный электролизер. Однако развитие электролиза устройств в процессе настоящее время, а вместе с развитием протонной обменной мембраной, которая может быть использована в водных электролизеров и топливных элементов, наряду с развитием высокотемпературных твердооксидных электролизеров Аналогично оптимизации щелочных электролизерах ( Kreuter Вт, и Hofmann H (1998 ).
2.2. ПОСТОЯННЫЙ ТОК ЭЛЕКТРОЛИЗА ВОДЫ
При растворении кислоты в воде (например, серной кислоты), молекулы воды и кислоты диссоциируют на ионы. То же самое происходит, если щелочь (например, KOH), растворяют в воде, раствор диссоциирует на ионы, создавая ионный проводник или электролит. Там была сформирована в ионный проводник, где постоянный ток будет передана через. Процессы, происходящие на электродах в случае серной кислоты — положительный гидроксония ионы Н 3 О + (катион) движутся в сторону отрицательного электрода. Когда катионы достичь электрод, они получают недостающие электроны ( Zoulias др. все, 2002 ):
Водород получают в виде газа из среды, в свою очередь, вода диссоциирует на ионы снова. Реакционную на анода или положительного электрода в щелочной среде ( Zoulias др. концов, 2002 ):
Кислород развивается как газ, но вода диссоциирует на ионы снова. Там производятся три части объема газообразного вещества в процессе, описанном — две части водорода и одного — кислорода. В случае щелочного электролита есть поляризованные молекулы воды, которые имеют свои атомы водорода, ориентированные на электроде, вблизи катода и диссоциации имеет место реакция:
Первый закон термодинамики для открытой системы говорится, что:
где Q является количество тепла подается в систему, Вт с количество соответствующей работы, выполняемой системой и ΔH является изменение энтальпии системы. Работа, проделанная электричество используется в электролизер, поэтому W с является:
н — количество переданных электронов;
F — постоянная Фарадея: = 23074 кал / вольт . г-эквивалентно;
E — электрический потенциал клетки в вольтах.
Использование уравнения (5) , преобразуем выражение (4), в результате чего:
В обратимого процесса изотермического (без потери) Q является:
где Т -абсолютная температура и ΔS является изменение энтропия системы. Из (6) и (7) величина обратимой реакции потенциала получается, когда невозможно для разложения воды на водород и кислород в реальном времени:
(H — ΔS) является изменение свободной энергии Гиббса ΔG . При нормальной температуре и давлении ((25 O температуры C и давлении в 1 атм) ΔH равна 68 320 кал / гмоль и ΔG равна 56 690 кал / гмоль Поэтому обратимый потенциал клетки.:
Потенциал где Q равна нулю и поставляется энергия трансформируется в энергию химических связей, называется термо-напряжение нейтрали ( Олдхэм и Myland, 1993 ; Бокриса и Поттер, 1952):
Напряжение для расщепления воды на практике электролиза устройств выше, чем термо-нейтральным напряжения ячейки должным преобразования в тепло, которое нагревает ячейку. Поэтому промышленный электролизер требуется дополнительное охлаждение, и значение напряжения постоянного тока определяется:
В уравнении (12) E анода — активация перенапряжения анода; E катод — активация перенапряжения катода; E т — перенапряжение массопереноса и ИК — активная перенапряжения (включает сопротивление в электролите, на электродах, приводит). Плотность тока должна быть выше, чем 100 мА / см 2 в промышленных электролизерах, поэтому напряжение, приложенное к отдельной клетки частично переходит в тепло, став типичным потеря постоянного тока электролиза воды.
Можно написать выражение для КПД электролиза воды, рассчитанный по отношению к термо-нейтральным напряжения, используя отношения выше (Бокриса и Поттер, (1952):
При ΔG отрицательна, реакции спонтанны и работа была проделана по высвобождая энергию. При ΔG положительна, для реакции произойдет внешней работы должны быть использованы. Что касается обеспечения реакцию, работа должна быть сделана, вода электролизер не работает спонтанно. Реакционную в топливных элементах спонтанно из-за катализатора в процессе реакции и энергия выделяется ( Salem, 2004 ).
Водород Evolution Reaction (HER) является одним из наиболее широко изучены реакции в электрохимии. Исследования НЕЕ осуществляются в различного рода систем и следующих друг за другом процессов делится ( Салем, 2004 ; Гейровский 2006 ; Мерфи, 1983; Бокриса, 1957 ; Эль-Meligi, 2009; Сасаки и Мацуда, 1981 ; Ноэль и ВАСУ, 1990 ; Kristalik, 1965): Volmer стадия электрохимического разряда, Гейровский электрохимический стадию десорбции, Tafel каталитического шаг рекомбинации. Каждый из шагов может быть реакцией ограничение шаг в определенной системе в течение всей реакции. Это означает, что каждый шаг может иметь разную скорость реакции, а самый медленный шаг будет определить скорость реакции. Перенос заряда может начаться, когда реагент находится рядом с электродом. Два наиболее типичные шаги перенос заряда заканчивая адсорбции атома водорода, и рекомбинация адсорбированных атомов с следующего десорбции H 2 молекулы.
Общее уравнение электрохимической реакции связывает ток с потенциалом ( Ноэль и ВАСУ, 1990 ):
β является фактором симметрия (0, ½, 1 для процесса без активации, нормальный процесс, и для инвалидов по зрению процесс соответственно).
2.3. ИНТЕРФЕЙС МЕЖДУ ЭЛЕКТРОДОМ И ЭЛЕКТРОЛИТОМ: ДВОЙНОЙ СЛОЙ
Когда две равные электроды (проводников) погружают в электролит, первоначально нет измеряемое напряжение между ними. Но когда ток должен течь от одного стержня на другой с помощью батареи, разделение зарядов, естественно, созданный на каждом жидкость / твердое тело и два электрохимические конденсаторы, соединенные последовательно создаются. Типичные конденсаторы хранить электрический заряд физически, без химических или фазовых изменений, происходящих, и этот процесс является весьма обратимым; цикл разрядки-зарядки можно повторять снова и снова, практически без ограничений. В электрохимического конденсатора на границе раздела электрод / электролит сольватированными ионов в электролите притягиваются к поверхности электрода равной, но противоположным зарядом в нем. Эти две параллельные регионы обвинению в интерфейсе образуют «двойной слой», где разделение зарядов измеряется в молекулярных размеров (то есть, несколько ангстрем), а площадь поверхности измеряется в тысячах квадратных метров на грамм материала электрода ( Miller и Симон, 2008 ).
Двухслойные явления и электро-кинетическое процессы основные элементы электрохимии. Считается, что поведение интерфейса и должна быть описана в терминах конденсатора. Это является следствием «свободного заряда» подход, что и в случае непрерывного потока текущей через интерфейс строгий следует проводить различие между так называемыми без Фарадея и Фарадея токов. Бывший отвечает за зарядки двухслойного конденсатора, а второй представляет собой поток заряда связано с процессами переноса заряда, происходящих на границе раздела ( Horanyi, Ланг, 2006 ). Состояние интерфейса при постоянном давлении и температуре может быть изменен путем изменения концентрации компонентов в объемных фаз, и путем построения электрическую цепь при помощи противоэлектрода и заставляя электрический ток через цепь, которая может быть выражена как:
Были я `заряжается ток двойного слоя, и я « — перенос заряда или Фарадея ток. Двойной слой ток зарядки можно рассматривать как идеальный зарядки конденсатора ток, равный
, который вызвал много дискуссий. Пол Delahais писал в 1966, что это уравнение допускает разъединение не-Фарадей от Фарадея процессах, но в то же время к выводу, что передача Фарадея заряд и процессы зарядки не может быть отделена априори в не-стационарных электродных процессов из-за явления из разделения зарядов или рекомбинации на границе раздела электрод-электролит без потока внешнего тока. Зарядка поведения как идеального поляризованной или обратимой электрода представляют только два предельных случая более общем случае ( Делахея, 1966 ). Nisancioglu и Ньюман (2012 ) в своей статье evenwithout вдаваясь в theassumptions и основываясь только на массового balanceequation, получены следующий currentequation: я = DQ / DT + я» и показал, что априори разделение заряда двойного слоя и Фарадея процессов в электродных реакций является компонентом баланс массы для поверхности электрода. Уравнение (1) справедливо, если скорость изменения концентрации виды, которые принимают участие в электродной реакции, можно пренебречь на поверхности электрода.
2.4. ВОДА РАСЩЕПЛЕНИЕ С ИМПУЛЬСНЫМ ЭЛЕКТРОЛИЗОМ
Существуют различные способы расщепления воды Первый отзыв от Бокриса др. все (1985 ), что резко отличается от обычного электролиза постоянного тока воды. Наиболее распространенным могут быть: термо химической, сонохимический, фотокаталитический, биологическая расщепление воды; вода расщепление под магнитного поля и центробежной силы вращения; импульсов электролиза и плазменном электролизе. Что касается импульса электролиза, Ghoroghchian и Бокриса в 1956 году уже определено, что импульсный электролиз является более эффективным, чем обычный электролиз. Многие новые патенты на импульсном электролизе появились в 1970-1990 ( Хорват, 1976 ; Spirig, 1978 ; Themu, 1980 ; Пухарич, 1983 ; Мейер, 1986 ; Мейер, 1989 ; Мейер, 1992a, 1992b ; Сантилли, 2001 ; Чемберс, 2002 ) том, чтобы изобрести над эффективным электролиза (т.е. выход по току выше, чем 100%). Схема воды расщепления описаны в этих патентах инициировал огромный интерес, но никто не преуспел в интерпретации этих схем и механизмов их производительности до сих пор, и что более важно, никто не преуспел на неоднократные запатентованных устройств экспериментально, а также.
В прервана DC электролиза диффузионный слой на электроде можно разделить на две части: одну часть, которая находится на электроде surfaceis характеризуется импульсной концентрации активных ионов, а другая часть фиксируется, подобно диффузионного слоя в случае DC . Концентрация активных ионов в пульсирующий изменения диффузионный слой с определенной начальной величины, когда импульс накладывается, к следующему значению, когда он истек. Концентрация активных ионов в импульсе может упасть или не может упасть до нуля. Время, которое необходимо для активной концентрации ионов упадет до нуля, называется временем τ переход. Время перехода в зависимости от импульсного тока я р и длительности импульса T . Если истощение в стационарном диффузионного слоя мала, т.е. с ‘ е ≈ с 0 , были с ‘ е является концентрация ионов в импульсно-слоя внешнего края, а с 0 является объемная концентрация, время перехода может быть найден из уравнения Sand (Ботт , 2000):
были F постоянна, Фарадея г — заряд число и D является его коэффициент диффузии. Как видно, время перехода τ зависит от концентрации ионов в насыпной объем с 0 и пульс плотность тока я р . Толщина слоя δ импульсного р в конце импульса зависит только от плотности импульсного тока:
С очень коротких импульсов очень тонкий пульсирующий слой может быть достигнута. Этот тонкий слой позволит временно наложить очень высокой плотности тока в течение металлических покрытий (более 250A/cm 2 , который в 10000 раз выше, чем в обычных токов электролиза), который ускоряет процесс гальванического металла ( Ibl др. концов, 1978 ) . Грубая и пористая поверхность образуется при металлических покрытий с постоянным током, когда текущее значение достигло предела массы транспорта. Когда покрытие делается с импульсным током, пульсирующий диффузионного слоя всегда будет намного тоньше, чем шероховатость поверхности, что означает, что в случае достигается предел массоперенос, покрытая поверхность однородна еще и скопировать шероховатости подложки. Эта функция дает предпочтение импульсного тока в гальванических процессах металлических, по сравнению с обычным покрытием постоянного тока, так как самая высокая возможная мощность может использоваться (ток выше предела массообмена) для получения однородных покрытий в кратчайшие сроки ( Ibl др. концов, 1978 ).
Импульсный электролиз широко исследованы с использованием различных технологий ( Hirato ET все, 2003 ; Курода и др. все 2007 ; Чандрасекар др. все 2008 ). Во всех этих технологий прямоугольные импульсы в основном используются который должен быть активным в природе. Shimizu и др. все (2006 ) применили импульсы индуктивного напряжения для электролиза воды и показали значительные различия с обычными постоянного тока электролиза воды. Вывод этого исследования является то, что этот вид эффективности электролиза воды не зависит от мощности электролиза, таким образом, находясь в противоречии с традиционной мнению электролиза.
Мы изучили индуктивный электролиза напряжение и способствовало гипотезу, что импульсный процесс отделяет геометрическую емкость клеток и двойной слой зарядный ток от электрохимической тока реакции с зарядом передачи ( Ванагс (2009 ), Ванагс (2 011a , 2011b). Чтобы доказать это мы сделали . много экспериментов, подтверждающих двойной слой разделение процесса зарядки от электрохимической реакции воды расщепления Там нет никаких исследований об использовании реактивной импульса короткого напряжения в водной электролиза раствора; также нет микроэлектродов не используются для определения присутствия растворенного водорода и кислорода вблизи катод в процессе электролиза.
Видео:Крещение, как подзарядиться энергией земли через воду при помощи электродов? Купаться ли в проруби?Скачать

3. Экспериментальная
3.1. МАТЕРИАЛЫ И ОБОРУДОВАНИЕ
Материалы, инструменты и оборудование, используемые в этой работе собраны в таблицах 1 и 2 .
3.2. ГЕНЕРАТОР ИНДУКТИВНЫЙ ОБРАТНОЕ НАПРЯЖЕНИЕ ИМПУЛЬСА
Импульсы индуктивные напряжения были получены в электрической цепи ( рис. 1.) , состоящий из генератора импульсов, источником питания постоянного тока, полевой транзистор BUZ350, и блокирующим диодом (Shaaban, 1994 года, Smimizu др. всех, 2006). Особое широкополосный трансформатор был бифилярно раны с помощью двух проводов, скрученных вместе. Прямоугольных импульсов от генератора были применены к полевого транзистора соединены последовательно с источником питания постоянного тока. Коэффициент заполнения импульсов поддерживали постоянным (50%). Для получения индуктивных импульсов обратного напряжения, первичная обмотка трансформатора работает с малой амплитуды импульсов квадратных напряжения. В вторичной обмотки (обмоток ratio1: 1) в связи с распадом магнитного поля, создаваемого в катушке возникает очень острая индуктивный датчик импульсов с большой амплитудой и противоположной полярности по отношению к приложенного напряжения. Пульс индуцированного обратного напряжения проходит через блокировочный диод, а полученный
1 мкс широкий импульс высокого напряжения на электролизере. Двухлучевой осциллограф GWinstek GDS-2204 был использован для записи напряжения (то есть его падение на эталонном сопротивлении) и ток в цепи.
МОП-транзистор (IRF840) используется в качестве полупроводникового переключателя между источником питания постоянного тока и цепи заземления. Импульсный трансформатор является соленоидом с бифилярными обмоток; длина 20 см и диаметр катушки 2,3 см и ферритовым сердечником стержня. Число оборотов в оба первичной и вторичной обмотки 75, поэтому соотношение составляет 1:1. Индуктивность соленоида составляет примерно 250 мкГн. Супер-быстрая блокировка диод со временем закрытия 10 нс входит во вторичной цепи, чтобы передать электролизера только импульсы, вызванные трансформатор с противоположной полярности. Прямые импульсы блокируются диода.
| Нет | Название | Параметры | Производитель | |
| Химикалии | 1. | КОН | 99% | Олдрич |
| 2. | NaOH | 99% | Олдрич | |
| 3. | LiOH | 99,9% | Олдрич | |
| 4. | К 2 СО 3 | 99,8% | Олдрич | |
| 5. | Н 2 SO 4 | 95% | Олдрич | |
| 6. | (NH 2 ) 2 CO | 98% | Олдрич | |
| 7. | H 2 O | 0,1 мкс | Деионизированная | |
| Металлы | 1. | Нержавеющая сталь (параметры Таблица 2) | 316L | |
| 2. | Вольфрам | 95% | Олдрич | |
| 3. | Платина | 99,9% | Олдрич | |
| Оборудование и инструменты | 1. | Источник питания постоянного тока Agilent N5751A | 300В; 2.5A | Aligent echnologies |
| 2. | Частота генератора GFG-3015 | 0 — 150 МГц | GW-Instek | |
| 3. | Осциллограф GDS-2204 | 4 луча, разрешение 10 нс | GW-Instek | |
| 4. | Измеритель мощности HM8115-2 | 16A, 300V | Hameg инструменты | |
| 5. | Вода Деионизация Кристалл — 5 | Вода — 0,1 мкс | Adrona Lab.Systems | |
| 6. | Masspectrometer RGAPro 100 | 0 — 100 м / г единиц | Hy-Энергия | |
| 7. | Рентгеновский флуоресцентный спектрометр EDAX / Ametek, Орел III | Ametek | ||
| 8. | Микросенсоров для растворенных газов H 2 и O 2 | Разрешение 0,1 мкмоль / л | Unisense, Дания |
ТАБЛИЦА 1.
Материалы и оборудование, используемые в этой работе.
| Элемент | С | Си | Р | S | Ti | Cr | Миннесота | Фе | Ni | Cu |
| Количество, вес% | 0.12 | 0.83 | 0.04 | 0.02 | 0,67 | 17.88 | 2.02 | 68.36 | 9.77 | 0,29 |
ТАБЛИЦА 2.
Состав из нержавеющей стали 316L используется для электродов (мас.%).
🎬 Видео
Обратная сторона воды. Вода после электролизаСкачать

гидролизёр 2Скачать

Почему при электролизе воды водород и кислород выделяется на электродах, а не в объеме.Скачать

ПОЛУЧЕНИЕ ВОДОРОДА В ДОМАШНИХ УСЛОВИЯХ ⚡ электролиз водыСкачать

ЭЛЕКТРОЛИЗ ДРАГМЕТАЛЛОВ И ЦВЕТНИНЫ.В КЕГЕ ИЗ ПОД ВОДЫ.Скачать

Последствия электролиза для электродовСкачать

Графитовый электрод в корпусе для получения газа при электролизе воды с пищевой содойСкачать

Секрет электролизера с максимальным КПДСкачать