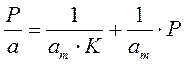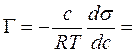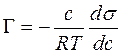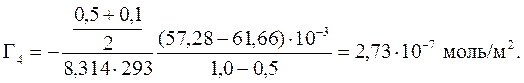Видео:26. Взаимодействие молекул. Длина свободного пробегаСкачать

Уравнение изотермы адсорбции Ленгмюра
Конечно, предположение, что молекулы адсорбируются с одинаковой вероятностью на любых участках поверхности, в том числе и уже занятых ранее — слишком грубое допущение, пригодное лишь для очень малых степеней покрытия.
Теория Ленгмюра позволяет учесть наиболее сильные отклонения от закона Генри, что связано с ограничением адсорбционного объема или поверхности адсорбента. Ограниченность этого параметра приводит к адсорбционному насыщению поверхности адсорбента по мере увеличения концентрации распределяемого вещества. Это положение уточняется следующими утверждениями.
1) Адсорбция локализована на отдельных адсорбционных центрах, каждый из которых взаимодействует только с одной молекулой адсорбента — образуется мономолекулярный слой.
2) Адсорбционные центры энергетически эквивалентны — поверхность адсорбента эквипотенциальна.
3) Адсорбированные молекулы не взаимодействуют друг с другом.
Простейший вывод уравнения Ленгмюра, данный Кисилевым, основан на рассмотрении химического (в случае хемосорбции) или квазихимического (в случае физической адсорбиии) равновесия молекула газа + свободное место↔адсорбированная молекула.
Для обычного выражения константы равновесия через концентрации участников рассматриваемого процесса необходимо условиться о способах их выражения. Концентрация адсорбированных молекул может быть выражена не только числом адсорбированных молекул на 1 м 2 поверхности, но и в относительных единицах через долю занятой поверхности (степень заполнения поверхности) θ. Тогда, в тех же единицах, концентрация свободных мест 1-θ. Концентрация молекул газа (а молях на миллилитр) может быть заменена пропорциональной ей величиной давления Р (равновесное давление адсорбата в объеме фазы, граничащей с адсорбентом). Такая свобода в выборе единиц рассматриваемых концентраций обусловлена тем, что соответствующие константы пропорциональности могут быть объединены с константой равновесия. Итак, константа равновесия
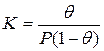
Решение этого уравнения относительно θ приводит к выражению
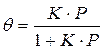
Если а, как и раньше, есть величина адсорбции (моль/см 2 или см 3 /г), а am — величина адсорбции, соответствующая полному заполнению поверхности (емкость монослоя, моль/см 2 ), то степень заполнения θ=a/am, (2.8)
т.е. 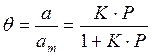
отсюда 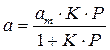
В такой форме уравнение Ленгмюра широко известно. Оно содержит две константы: am, кратко называемая емкостью монослоя, и K — константа, зависящая от энергии адсорбции и температуры.
Итак, уравнение Ленгмюра – это уравнение монослойной адсорбции на однородной поверхности в отсутствие сил притяжения между молекулами адсорбата.
Посмотрим, какую форму примет уравнение при крайних значениях поверхностной концентрации адсорбированного вещества.
В области малых концентраций, т.е. при малых давлениях, КР >1, и единицей в знаменателе можно пренебречь:
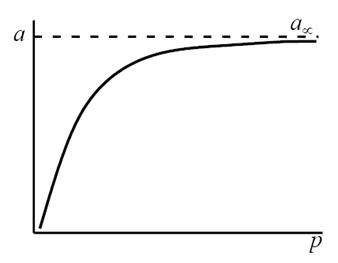
т.е. величина адсорбции стремится к пределу, при котором она уже практически не зависит от давления (участок 3 изотермы адсорбции). В промежуточной области (участок 2) зависимость адсорбции от давления описывается самим уравнением (2.10).
Рис. 2.5. Три участка изотермы адсорбции Ленгмюра
Таким образом, по модели Ленгмюра, вначале адсорбция растет пропорционально давлению газа, затем, по мере заполнения мест на поверхности, этот рост замедляется и, наконец, при достаточно высоких давлениях рост адсорбции практически прекращается, так как покрытие поверхности становится весьма близким к монослойному. Необходимо подчеркнуть, однако, что по этой модели завершение образования монослоя происходит лишь при бесконечно высоком давлении. Форма изотермы адсорбции, предсказываемая уравнением Ленгмюра, экспериментально наблюдается в случае химической адсорбции на однородных поверхностях. Для физической адсорбции такое соответствие наблюдается только в начальной области изотермы. При больших заполнениях не получается предсказываемого теорией приближения к насыщению и изотерма продолжает подъем с ростом давления, причем она становится даже более крутой.
Для удобной проверки приложимости уравнения Ленгмюра к экспериментальным данным преобразуем его в линейную форму. Разделим обе части уравнения (2.10) на Р:
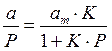
Перевернем дроби по обе части равенства:
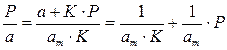
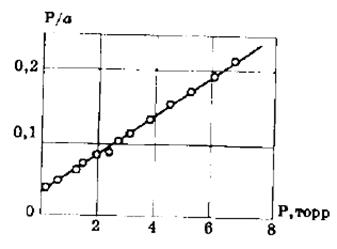
Если по оси абсцисс откладывать Р, а на оси ординат Р/а, то в случае выполнимости уравнения Ленгмюра экспериментальные точки должны укладываться на прямую. Начальной ординатой будет 1/(аm∙К), тангенсом угла наклона прямой 1/аm. Из того и другого выражения легко вычислить обе константы am и К. Пример такого построения показан на рис. 2.6, где экспериментальные точки для адсорбции бензола на графитированной саже, в соответствии с указанными ранее, легли па прямую только в области малых давлений (до Р/Р0 =0.1).
Рис. 2.6. Изотерма адсорбции бензола при 20 о С на графитированной саже в координатах линейной формы уравнения Ленгмюра
Имеется немало примеров, когда уравнение Ленгмюра не выполняется. Объясняется это тем, что не оправдываются оба допущения теории об однородности поверхности и отсутствии взаимодействия молекул, особенно первое из них. Тот факт, что имеются случаи адсорбции на реальных неоднородных поверхностях, когда уравнение Ленгмюра все же удовлетворительно описывает экспериментальные данные, Брунауер объясняет тем, что в некотором интервале адсорбция происходит не на всей поверхности адсорбента, а только на части ее, именно на местах с примерно одинаковой теплотой адсорбции. Тогда в этом интервале уравнение Ленгмюра будет справедливо. После того, как эти места заполнены, начинает заполняться следующая серия мест с меньшей теплотой адсорбции. Поэтому для совокупности всех мест поверхности уравнение Ленгмюра может быть непригодно, а для части этих мест — справедливо. Отсюда, выполнимость его для разных адсорбентов зависит от соотношения участков с разной теплотой адсорбции.
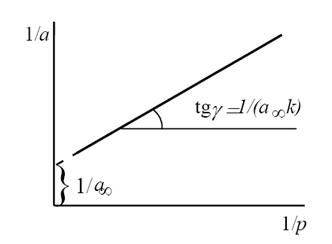
Константы уравнения (2.10) K и am могут быть определены графическим способом (рис. 2.7). Для этого уравнение Ленгмюра приводят к следующему линейному виду, разделив единицу на уравнение (2.10):
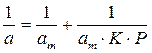
Рис. 2.7. Линейная форма уравнения изотермы Ленгмюра (a∞=am)
Зная емкость монослоя, можно определить удельную поверхность адсорбента Sуд (м 2 /г или см 2 /г) если известна площадь ω, занимаемая частицей в плотном адсорбционном слое (площадь, занимаемая одной молекулой азота в адсорбционном слое ω = 0.162 нм 2 ):
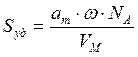
где аm — емкость монослоя — это количество адсорбата, которое может разместиться в полностью заполненном адсорбционном слое толщиной в 1 молекулу — монослое – на поверхности единицы массы (1г) твердого тела; ω — средняя площадь, занимаемая молекулой адсорбата в заполненном монослое, NA — число Авогадро (6,022·10 23 молекул/моль); VM — молярный объем адсорбата (газа) (VM = 22,41 л/моль=22,41∙10 -3 м 3 /моль).
Уравнение Ленгмюра можно использовать только при адсорбции в мономолекулярном слое. Это условие выполняется при хемосорбции, физической адсорбции газов при меньшем давлении и температуре выше критической.
Однако в большинстве случаев мономолекулярный адсорбционный слой не компенсирует полностью избыточную поверхностную энергию и поэтому остается возможность влияния поверхностных сил на второй и т.д. адсорбционные слои. Это реализуется в том случае, когда газы и пары адсорбируются при температуре ниже критической, т.е. образуются полимолекулярные слои на поверхности адсорбента, что можно представить как вынужденную конденсацию В этом случае используют уравнение БЭТ (Брунауер –Эммет — Теллер).
Пример 2.1. При адсорбции азота на активированном угле при 220К получены следующие данные:
Р, Па 5310 9800 18000 33000 70000
a, cм 3 /г 7 14 23 32 51
Плотность газообразного азота ρ=1,2506 кг/м 3 . Площадь, занимаемая одной молекулой азота в насыщенном монослое, составляет ω = 0.162 нм 2 . VM — молярный объем адсорбата (газа) (VM = 22,41 л/моль=22,41∙10 -3 м 3 /моль).
Постройте изотерму адсорбции в линейных координатах. Графически определите константы аm и К уравнения Ленгмюра, пользуясь которыми, постройте изотерму Ленгмюра. Определите удельную поверхность активированного угля Sуд.
Решение. Линейная форма уравнения Ленгмюра выражается (2.15):
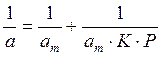
Определим 1/аm и 1/ р:
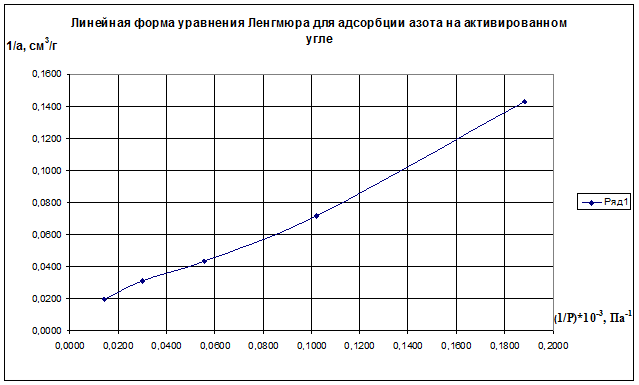
(1/р)·10 -3 , Па 0,1883 0,1020 0,0556 0,0303 0,0143
1/а·, см 3 /г 0,143 0,071 0,043 0,031 0,020
Строим график зависимости 1/а=f(1/р)∙10 -3 (рис.2.8). По графику находим 1/аm как отрезок, отсекаемый прямой на оси ординат, для чего необходимо продлить полученную прямую до пересечения с осью ординат.
Рис.2.8. Линейная форма уравнения Ленгмюра для адсорбции азота на активированном угле
Уравнение прямой y=a+bx, имеет следующее формульное выражение:
Это выражение может быть определено с помощью регрессионного анализа в Microsoft Excel (встроенного пакета Анализ данных — Регрессия по значениям 1/аm и 1/ р).
Из уравнения получим 1/am=0,00698 г/см 3 .
Откуда получим: am=143,35 см 3 /г.
Далее находят тангенс угла наклона прямой к оси абсцисс tgα=1/(am∙K) по графику (или по уравнению регрессии). tgα=0,70099. Тогда, зная значения am и tgα, можно определить K=9,95 кг/м 3 .
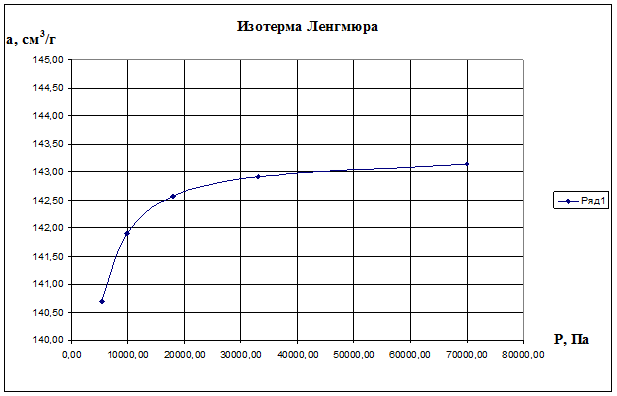
Теперь, зная константы аm и К уравнения Ленгмюра, построим изотерму Ленгмюра, для чего рассчитаем по формуле (2.10) значения а для различных значений Р и получим:
Р, Па 5310 9800 18000 33000 70000
a, cм 3 /г 140,69 141,90 142,56 142,92 143,15
По данным значениям построим изотерму Ленгмюра а=f(P), представлена на рис.2.9.
Рис. 2.9. Изотерма Ленгмюра а=f(P)
По формуле (2.16) рассчитаем удельную поверхность активированного угля: 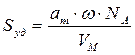
В случае, когда известна плотность вещества (адсорбента) ρ и молярная масса M, а не известен VM — молярный объем адсорбата удельную поверхность вещества (активированного угля) находят по формуле:
где am выражают в моль/кг.
Для азота М= 0,0280 кг/моль, ρ=1,2506 кг/м 3 .
Из расчетов видно, что два способа расчета Sуд дают почти одинаковые результаты.
Пример 2.2. Удельная поверхность непористой сажи равна 73,7м 2 /кг. Рассчитайте площадь, занимаемую молекулой бензола в плотном монослое, исходя из данных об адсорбции бензола на этом адсорбенте при 293 К.
Р, Па 1,03 1,29 1,74 2,50 6,67
а∙10 2 , моль/кг 1,57 1,94 2,55 3,51 7,58
Предполагается, что изотерма адсорбции описывается уравнением Ленгмюра.
Решение. Используем линейную форму записи уравнения Ленгмюра, заданную формулой (2.14):
Рассчитываем значения Р/а:
(Р/а)∙10 -2 , Па∙кг/моль 0,656 0,668 0,68 0,712 0,879
Р, Па 1,03 1,29 1,74 2,50 6,67
По этим данным строим график в координатах уравнения Ленгмюра в линейной форме P/a=f(P).
Из графика находим аm= Р/(Р/а) = 25,2∙10 -2 моль/кг.
Удельная поверхность адсорбента связана с емкостью слоя аm, выраженного в моль/кг, соотношением: Sуд=am∙ω∙NA (2.18)
Площадь, занимаемая молекулой бензола в плотном монослое, равна
ω = Sуд/(am NA) ==73,7 10 3 /(6,02 10 23 ∙25,210 -2 )=0,49∙10 -18 м 2 =0,49 нм 2 .
Видео:10 класс - Физика - Длина свободного пробега молекулы в газе. Явления, связанные с движением молекулСкачать

Коллоидная химия. Шпаргалка
Данное издание создано в помощь студентам вузов, которые хотят быстро подготовиться к экзаменам и сдать сессию без проблем. Пособие составлено с учетом Государственного образовательного стандарта.
Оглавление
- 1. Возникновение и основные этапы развития коллоидной химии. Предмет и объекты исследований коллоидной химии
- 2. Основные особенности дисперсных систем. Особенности ультрамикрогетерогенного состояния (наносостояния)
- 3. Различные типы классификации дисперсных систем. Лиофильные и лиофобные дисперсные системы
- 4. Дисперсность. Удельная поверхность дисперсных систем, методы ее измерения
- 5. Коллоиды. Примеры коллоидных систем, их распространенность в природе и значение для современной технологии
- 6. Оптические методы исследования дисперсных систем (нефелометрия, турбидиметрия)
- 7. Оптические свойства коллоидов. Статическое рассеяние света. Оптическая анизотропия
- 8. Поглощение света дисперсными системами, уравнение Бугера-Ламберта-Бера. Определение размеров коллоидных частиц
- 9. Поверхностные явления. Роль поверхностных явлений в процессах, протекающих в дисперсных системах
- 10. Поверхность раздела фаз. Свободная поверхностная энергия. Поверхностное натяжение. Адсорбция
- 11. Термодинамическое описание разделяющей поверхности
- 12. Адсорбция. Площадь, приходящаяся на одну молекулу в адсорбционном слое
- 13. Хроматографический адсорбционный анализ
Приведённый ознакомительный фрагмент книги Коллоидная химия. Шпаргалка предоставлен нашим книжным партнёром — компанией ЛитРес.
12. Адсорбция. Площадь, приходящаяся на одну молекулу в адсорбционном слое
Адсорбция (от лат. ad — «на, при» и sorbeo — «поглощаю») — это поглощение вещества из газообразной среды или раствора поверхностным слоем жидкости или твердого тела, следствием которого является самопроизвольное концентрирование веществ вблизи поверхности раздела фаз. Вещество, на поверхности которого происходит адсорбция, называется адсорбентом, а поглощаемое из объемной фазы вещество — адсорбатом. После адсорбции внутреннее притяжение частично компенсируется притяжением со стороны адсорбционного слоя, и поверхностное натяжение уменьшается. Слой жидкости, который прилегает к поверхности и равен по толщине радиусу сферы молекулярного взаимодействия, называется поверхностным слоем. Молекулы жидкости в поверхностном слое находятся под действием сил притяжения соседних молекул. Равнодействующая этих сил притяжения направлена в глубь жидкости, передвижение молекул из глубины жидкости в поверхностный слой требует затрат работы на преодоление сил межмолекулярного сцепления (когезии). Работа, выполняемая для увеличения поверхности жидкости на единицу, называется поверхностным натяжением. Поверхностное натяжение можно рассматривать как силу, которая действует на единицу длины контура, который ограничивает поверхность и пытается ее сократить по нормали к касательной к поверхности. Поверхностное натяжение измеряется в Дж/м 2 или Н/м. Работа по образованию новой поверхности, которая происходит в условиях изотермического или обратимого процесса (максимальная работа), осуществляется за счет изменения изохорно-изотермического потенциала.
Для единицы поверхности (S):
Поверхностное натяжение представляет собой свободную энергию единицы поверхности. Запас свободной поверхностной энергии гетерогенной системы с межфазной поверхностью раздела S: F = σ х s. Самопроизвольное стремление к уменьшению F системы может быть реализовано или путем уменьшения межфазной поверхности (например, при коагуляции), или за счет уменьшения поверхностного натяжения раствора. Если растворенное вещество способно уменьшать поверхностное натяжение раствора, то оно будет концентрироваться (адсорбироваться) на поверхностном слое. Эти вещества называют поверхностно-активными веществами (ПАВ). Связь между адсорбцией и поверхностным натяжением выражается уравнением Гиббса:
где Г — удельная адсорбция растворенного вещества в моль/м 2 , т. е. избыточная концентрация растворенного вещества в поверхностном слое раствора в сравнении с его объемной концентрацией с; s — поверхностное натяжение раствора, Дж/м 2 ; R — универсальная газовая постоянная; Т — температура, К.
Производная (изменение поверхностного натяжения с концентрацией) называется поверхностной активностью растворенного вещества. Такие вещества называются поверхностно-инактивными веществами (ПИАВ). Изменение поверхностного натяжения по сравнению с поверхностным натяжением растворителя описывается эмпирическим уравнением Шишковского:
σ0 — σ = B ln(1 + Ac) 12. Адсорбция. Площадь, приходящаяся на одну молекулу в адсорбционном слое
Приведённый ознакомительный фрагмент книги Коллоидная химия. Шпаргалка предоставлен нашим книжным партнёром — компанией ЛитРес.
Смотрите также
Философия. Конспекты + Шпаргалки. Две книги в одной!
Группа авторов, 2012
Гражданское право. Часть первая. Краткий курс
Коллектив авторов, 2016
Психология. Полный курс
Татьяна Петровна Ритерман, 2010
Статистика. Ответы на экзаменационные билеты
Ангелина Витальевна Яковлева, 2009
Ценные бумаги. Ответы на экзаменационные билеты
Надежда Новикова, 2009
Уголовный процесс. Шпаргалка
Михаил Белоусов, 2009
Бухгалтерское дело. Ответы на экзаменационные вопросы
О. В. Епифанов, 2009
Учебное пособие по органической химии. Часть 1. Алифатические соединения
Политология. Вопросы и ответы
А. А. Акмалова, 2008
Теория организации. Ответы на экзаменационные билеты
Сергей Викторович Загородников, 2009
Патентование изобретений в области высоких и нанотехнологий
Экономический анализ деятельности предприятия. Ответы на экзаменационные вопросы
С. С. Степанова, 2009
Ответы на экзаменационные вопросы по арбитражному процессуальному праву
Видео:Длина свободного пробегаСкачать

Определение площади, занимаемой молекулой поверхностно-активного вещества в насыщенном адсорбционном слое, и максимальной длины молекулы ПАВ
Если известна величина Г¥, то можно рассчитать площадь, занимаемую одной молекулойПАВ в насыщенном монослое S0
 . . | (318) |
где NA = 6,02×10 23 моль –1 – число Авогадро.
Толщина адсорбционного слоя, равная длине молекулы, рассчитывается по уравнению:
 , , | (319) |
где М – относительная молекулярная масса ПАВ; r – плотность ПАВ в жидком состоянии (Приложение 19).
Уравнение Шишковского
Зависимость поверхностного натяжения раствора ПАВ от его концентрации в растворе описывается уравнением Шишковского
 , , | (320) |
где В – эмпирическая константа, постоянная для данного гомологического ряда, которая равна
| В= RTГ∞ | (321) |
Поэтому уравнение Шишковского можно записать следующим образом:
 , , | (322) |
где G¥ – величина предельной адсорбции ПАВ в мономолекулярном слое на границе «ж – г», моль/м 2 ; K – константа адсорбционного равновесия, л/моль; с – концентрация ПАВ в растворе, моль/л.
В области концентрированных растворов, для которых Kc >> 1 уравнение Шишковского принимает вид:
 . . | (323) |
Это уравнение линейно в координатах «s – lnс». По графику, построенному в этих координатах (рис. 73), можно рассчитать константы G¥ и K, входящие в уравнение Шишковского и Ленгмюра.
Рис. 73. Схема расчёта констант в уравнении Шишковского в области концентраций Kс>>1 с помощью линеаризации уравнения
Правило Дюкло – Траубе
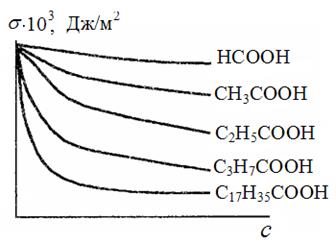
Влияние природы ПАВ на их поверхностную активность описывается правилом Дюкло-Траубе:
Ø В пределах одного гомологического ряда поверхностная активность ПАВ увеличивается в 3 – 3,5 раза при удлинении гидрофобной части на одну метиленовую группу (-СН2-).
Правилу Дюкло – Траубе соответствует уравнение:
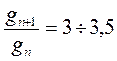 , , | (324) |
где gn – поверхностная активность ПАВ, содержащего n -CH2— групп, gn+1 – поверхностная активность ПАВ, содержащего n+1 ‑CH2— групп.
Правило Дюкло – Траубе выполняется вследствие того, что в пределах одного гомологического ряда ПАВ объем, занимаемый одной ‑CH2— группой постоянен.
Из рисунка (74) видно, что чем длиннее углеводородная цепь, тем быстрее снижается σ водного раствора с ростом концентрации ПАВ.
Рис. 74. Изотермы поверхностного натяжения для водных растворов карбоновых кислот при 298 К
Примеры решения задач
1. Определить адсорбцию (мкмоль/м 2 ) при 10°С для раствора, содержащего 50 мг пеларгоновой кислоты С8Н17СООН. Поверхностное натяжение исследуемого раствора 57,0×10 –3 Дж/м 2 . Считать, что поверхностное натяжение изменяется в указанном диапазоне концентраций линейно.
Находим 
Молярная концентрация кислоты в растворе равна:

По уравнению Гиббса (310) рассчитаем адсорбцию раствора пеларгоновой кислоты:
2. По уравнению Шишковского рассчитать поверхностное натяжение водного раствора масляной кислоты с концентрацией 0,104 моль/л при 273 К. Поверхностное натяжение воды при той же температуре 75,62×10 –3 Дж/м 2 . Константы уравнения Шишковского B = 12,6×10 3 Дж/м 2 , K = 21,5 л/моль.
По уравнению Шишковского (322), рассчитываем поверхностное натяжение водного раствора масляной кислоты, учитывая, что константа В определяется по уравнению (321):

3. Найдите значение адсорбции и площади, занимаемой одним ммолем уксусной кислоты при различных концентрациях, если при определении поверхностного натяжения растворов уксусной кислоты при 20°С были получены следующие результаты:
| с, моль/л | 0,01 | 0,1 | 0,5 | 1,0 | |
| σ, мДж/м 2 | 72,26 | 70,02 | 66,88 | 61,66 | 57,28 |
Рассчитываем величину адсорбции уксусной кислоты по уравнению (310):
Рассчитаем площадь, занимаемую одним ммолем уксусной кислоты при заданных концентрациях, по уравнению, которое следует из уравнения (318):
🎥 Видео
Взаимное притяжение и отталкивание молекул | Физика 7 класс #6 | ИнфоурокСкачать

Урок 140. Опыт Перрена. Масса молекул. Взаимодействие молекулСкачать

Урок 13 (осн). Взаимодействие молекул. Смачивание и несмачиваниеСкачать

Геометрия МолекулСкачать

Дипольный момент (видео 26) | Химические связи и структура молекул | ХимияСкачать

Поверхностные явления. Адсорбция.Скачать

Практическое занятие 5. Уравнение БЭТ. Удельная поверхностьСкачать

Конформации молекулСкачать
Биология 9 класс (Урок№4 - Органические молекулы. Углеводы. Липиды.)Скачать

Урок 197. Поверхностная энергия. Коэффициент поверхностного натяженияСкачать

Схема адсорбции молекул на границе раздела фаз «жидкость—твердое тело»Скачать

Поверхностные явления. Адсорбция на подвижных границах раздела фаз.Скачать

Адсорбция на поверхностях растворовСкачать

МОЛЯРНАЯ МАССА ХИМИЯ // Урок Химии 8 класс: Относительная Молекулярная МассаСкачать

1217. К.П. Катин: Молекулярная электроника. Приборы размером с молекулуСкачать

1.5. Пространственное строение органических молекулСкачать

Гибридизация и геометрические формы молекул доступным языком. (Общая химия)Скачать