Видео:Влияние площади поверхности на скорость реакций в гетерогенных системах. Опыт 2Скачать

Химическая кинетика. Скорость химических реакций
Темы кодификатора ЕГЭ: Скорость реакции. Ее зависимость от разных факторов.
Скорость химической реакции показывает, как быстро происходит та или иная реакция. Взаимодействие происходит при столкновении частиц в пространстве. При этом реакция происходит не при каждом столкновении, а только когда частица обладают соответствующей энергией.
Скорость реакции – количество элементарных соударений взаимодействующих частиц, заканчивающихся химическим превращением, за единицу времени.
Определение скорости химической реакции связано с условиями ее проведения. Если реакция гомогенная – т.е. продукты и реагенты находятся в одной фазе – то скорость химической реакции определяется, как изменение концентрации вещества в единицу времени:
υ = ΔC / Δt
Если реагенты, или продукты находятся в разных фазах, и столкновение частиц происходит только на границе раздела фаз, то реакция называется гетерогенной, и скорость ее определяется изменением количества вещества в единицу времени на единицу реакционной поверхности:
υ = Δν / (S·Δt)
Видео:Площадь поверхности призмы. 11 класс.Скачать

Факторы, влияющие на скорость химической реакции
Видео:Влияние соотношения площади поверхности к объему на скорость диффузии. 10 класс.Скачать

1. Температура
Самый простой способ изменить скорость реакции – изменить температуру . Как вам, должно быть, известно из курса физики, температура – это мера средней кинетической энергии движения частиц вещества. Если мы повышаем температуру, то частицы любого вещества начинают двигаться быстрее, а следовательно, сталкиваться чаще.
Однако при повышении температуры скорость химических реакций увеличивается в основном благодаря тому, что увеличивается число эффективных соударений. При повышении температуры резко увеличивается число активных частиц, которые могут преодолеть энергетический барьер реакции. Если понижаем температуру – частицы начинают двигаться медленнее, число активных частиц уменьшается, и количество эффективных соударений в секунду уменьшается. Таким образом, при повышении температуры скорость химической реакции повышается, а при понижении температуры — уменьшается .
Обратите внимание! Это правило работает одинаково для всех химических реакций (в том числе для экзотермических и эндотермических). Скорость реакции не зависит от теплового эффекта. Скорость экзотермических реакций при повышении температуры возрастает, а при понижении температуры – уменьшается. Скорость эндотермических реакций также возрастает при повышении температуры, и уменьшается при понижении температуры.
Более того, еще в XIX веке голландский физик Вант-Гофф экспериментально установил, что скорость большинства реакций примерно одинаково изменяется (примерно в 2-4 раза) при изменении температуры на 10 о С.
Правило Вант-Гоффа звучит так: повышение температуры на 10 о С приводит к увеличению скорости химической реакции в 2-4 раза (эту величину называют температурный коэффициент скорости химической реакции γ).
Точное значение температурного коэффициента определяется для каждой реакции.
здесь v2 — скорость реакции при температуре T2,
v1 — скорость реакции при температуре T1,
γ — температурный коэффициент скорости реакции, коэффициент Вант-Гоффа.
В некоторых ситуациях повысить скорость реакции с помощью температуры не всегда удается, т.к. некоторые вещества разлагаются при повышении температуры, некоторые вещества или растворители испаряются при повышенной температуре, т.е. нарушаются условия проведения процесса.
Видео:Как находить площадь любой фигуры? Геометрия | МатематикаСкачать

2. Концентрация
Также изменить число эффективных соударений можно, изменив концентрацию реагирующих веществ . Понятие концентрации, как правило, используется для газов и жидкостей, т.к. в газах и жидкостях частицы быстро двигаются и активно перемешиваются. Чем больше концентрация реагирующих веществ (жидкостей, газов), тем больше число эффективных соударений, и тем выше скорость химической реакции.
На основании большого числа экспериментов в 1867 году в работах норвежских ученых П. Гульденберга и П. Вааге и, независимо от них, в 1865 году русским ученым Н.И. Бекетовым был выведен основной закон химической кинетики, устанавливающий зависимость скорости химической реакции от концентрации реагирующих веществ:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их коэффициентам в уравнении химической реакции.
Для химической реакции вида: aA + bB = cC + dD закон действующих масс записывается так:
здесь v — скорость химической реакции,
CA и CB — концентрации веществ А и В, соответственно, моль/л
k – коэффициент пропорциональности, константа скорости реакции.
Например , для реакции образования аммиака:
закон действующих масс выглядит так:
Константа скорости реакции k показывает, с какой скоростью будут реагировать вещества, если их концентрации равны 1 моль/л, или их произведение равно 1. Константа скорости химической реакции зависит от температуры и не зависит от концентрации реагирующих веществ.
В законе действующих масс не учитываются концентрации твердых веществ, т.к. они реагируют, как правило, на поверхности, и количество реагирующих частиц на единицу поверхности при этом не меняется.
В большинстве случаев химическая реакция состоит из нескольких простых этапов, в таком случае уравнение химической реакции показывает лишь суммарное или итоговое уравнение происходящих процессов. При этом скорость химической реакции сложным образом зависит (или не зависит) от концентрации реагирующих веществ, полупродуктов или катализатора, поэтому точная форма кинетического уравнения определяется экспериментально, или на основании анализа предполагаемого механизма реакции. Как правило, скорость сложной химической реакции определяется скоростью его самого медленного этапа (лимитирующей стадии).
Видео:Скорость химической реакцииСкачать

3. Давление
Концентрация газов напрямую зависит от давления . При повышении давления повышается концентрация газов. Математическое выражение этой зависимости (для идеального газа) — уравнение Менделеева-Клапейрона:
pV = νRT
Таким образом, если среди реагентов есть газообразное вещество, то при повышении давления скорость химической реакции увеличивается, при понижении давления — уменьшается .
Например. Как изменится скорость реакции сплавления извести с оксидом кремния:
при повышении давления?
Правильным ответом будет – никак, т.к. среди реагентов нет газов, а карбонат кальция – твердая соль, нерастворимая в воде, оксид кремния – твердое вещество. Газом будет продукт – углекислый газ. Но продукты не влияют на скорость прямой реакции.
Видео:Что такое площадь. Как найти площадь прямоугольника?Скачать

4. Катализатор
Еще один способ увеличить скорость химической реакции – направить ее по другому пути, заменив прямое взаимодействие, например, веществ А и В серией последовательных реакций с третьим веществом К, которые требуют гораздо меньших затрат энергии (имеют более низкий активационный энергетический барьер) и протекают при данных условиях быстрее, чем прямая реакция. Это третье вещество называют катализатором .
Катализаторы – это химические вещества, участвующие в химической реакции, изменяющие ее скорость и направление, но не расходующиеся в ходе реакции (по окончании реакции не изменяющиеся ни по количеству, ни по составу). Примерный механизм работы катализатора для реакции вида А + В можно представить так:
A + K = AK
AK + B = AB + K
Процесс изменения скорости реакции при взаимодействии с катализатором называют катализом. Катализаторы широко применяют в промышленности, когда необходимо увеличить скорость реакции, либо направить ее по определенному пути.
По фазовому состоянию катализатора различают гомогенный и гетерогенный катализ.
Гомогенный катализ – это когда реагирующие вещества и катализатор находятся в одной фазе (газ, раствор). Типичные гомогенные катализаторы – кислоты и основания. органические амины и др.
Гетерогенный катализ – это когда реагирующие вещества и катализатор находятся в разных фазах. Как правило, гетерогенные катализаторы – твердые вещества. Т.к. взаимодействие в таких катализаторах идет только на поверхности вещества, важным требованием для катализаторов является большая площадь поверхности. Гетерогенные катализаторы отличает высокая пористость, которая увеличивает площадь поверхности катализатора. Так, суммарная площадь поверхности некоторых катализаторов иногда достигает 500 квадратных метров на 1 г катализатора. Большая площадь и пористость обеспечивают эффективное взаимодействие с реагентами. К гетерогенным катализаторам относятся металлы, цеолиты — кристаллические минералы группы алюмосиликатов (соединений кремния и алюминия), и другие.
Пример гетерогенного катализа – синтез аммиака:
В качестве катализатора используется пористое железо с примесями Al2O3 и K2O.
Сам катализатор не расходуется в ходе химической реакции, но на поверхности катализатора накапливаются другие вещества, связывающие активные центры катализатора и блокирующие его работу (каталитические яды). Их необходимо регулярно удалять, путем регенерации катализатора.
В биохимических реакция очень эффективными оказываются катализаторы – ферменты. Ферментативные катализаторы действуют эффективно и избирательно, с избирательностью 100%. К сожалению, ферменты очень чувствительны к повышению температуры, кислотности среды и другим факторам, поэтому есть ряд ограничений для реализации в промышленных масштабах процессов с ферментативным катализом.
Катализаторы не стоит путать с инициаторами процесса и ингибиторами.
Например , для инициирования радикальной реакции хлорирования метана необходимо облучение ультрафиолетом. Это не катализатор. Некоторые радикальные реакции инициируются пероксидными радикалами. Это также не катализаторы.
Ингибиторы – это вещества, которые замедляют химическую реакцию. Ингибиторы могут расходоваться и участвовать в химической реакции. При этом ингибиторы не являются катализаторами наоборот. Обратный катализ в принципе невозможен – реакция в любом случае будет пытаться идти по наиболее быстрому пути.
Видео:Влияние площади поверхности на скорость реакцииСкачать

5. Площадь соприкосновения реагирующих веществ
Для гетерогенных реакций одним из способов увеличить число эффективных соударений является увеличение площади реакционной поверхности . Чем больше площадь поверхности контакта реагирующих фаз, тем больше скорость гетерогенной химической реакции. Порошковый цинк гораздо быстрее растворяется в кислоте, чем гранулированный цинк такой же массы.
В промышленности для увеличения площади контактирующей поверхности реагирующих веществ используют метод «кипящего слоя».
Например , при производстве серной кислоты методом «кипящего слоя» производят обжиг колчедана.
Видео:Про катализатор что и как, зачем и почему.Скачать

6. Природа реагирующих веществ
На скорость химических реакций при прочих равных условиях также оказывают влияние химические свойства, т.е. природа реагирующих веществ.
Менее активные вещества будут имеют более высокий активационный барьер, и вступают в реакции медленнее, чем более активные вещества.
Более активные вещества имеют более низкую энергию активации, и значительно легче и чаще вступают в химические реакции.
Более стабильные вещества — это, например, те вещества, которые окружают нас в быту, либо существуют в природе.
Например , хлорид натрия NaCl (поваренная соль), или воды H2O, или металлическое железо Fe.
Более активные вещества мы можем встретить в быту и природе сравнительно редко.
Например , оксид натрия Na2O или сам натрий Na в быту и в природе не не встречаем, т.к. они активно реагируют с водой.
При небольших значениях энергии активации (менее 40 кДж/моль) реакция проходит очень быстро и легко. Значительная часть столкновений между частицами заканчивается химическим превращением. Например, реакции ионного обмена происходят при обычных условиях очень быстро.
При высоких значениях энергии активации (более 120 кДж/моль) лишь незначительное число столкновений заканчивается химическим превращением. Скорость таких реакций пренебрежимо мала. Например, азот с кислородом практически не взаимодействует при нормальных условиях.
При средних значениях энергии активации (от 40 до 120 кДж/моль) скорость реакции будет средней. Такие реакции также идут при обычных условиях, но не очень быстро, так, что их можно наблюдать невооруженным глазом. К таким реакциям относятся взаимодействие натрия с водой, взаимодействие железа с соляной кислотой и др.
Вещества, стабильные при нормальных условиях, как правило, имеют высокие значения энергии активации.
Видео:Влияние катализатора на скорость химических реакцийСкачать

Методы определения поверхности по изотермам адсорбции
Эти методы делят на три основные группы: объемные, весовые и методы, основанные на измерении теплопроводности (динамические).
В объемном методе при данном давлении измеряют изменение объема газа, которое и служит мерой количества адсорбированного вещества [218, 219]. При работе весовым методом определяют привес твердой фазы (адсорбент—адсорбат), обусловленный адсорбцией газа [219]. В методах, основанных на измерении теплопроводности, используют ячейку, которая позволяет определить изменение теплопроводности потока газа, проходящего над сорбентом, вследствие изменения состава газа, вызванного адсорбцией или десорбцией [218]. Динамические методы приобрели распространение в связи с развитием газовой хроматографии [20, 51 ].
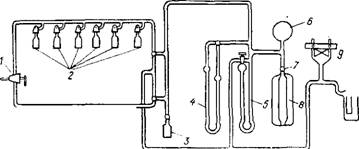
Объемные методы. В настоящее время наиболее распространены объемные методы определения поверхности. Разработано много вариантов вакуумных установок такого типа [51, 219 ]. Схема одной из объемных установок приведена на рис. 5.6.
Обязательным условием работы объемным методом является хорошее (до ±0,05 °С) термостатирование измерительной бюретки. Для создания в приборе разрежения к нему присоединяют форвакуумный насос. С помощью колбы 8, откалиброванной до подключения к установке, производят все необходимые измерения объемов системы. Ртутный манометр 5 предназначен для измерения давления в системе, а масляный 4 — для определения изме-
Рис. 5.6. Адсорбциоииая установка для определения площади поверхности объемным
1 — кран для подачи азота; 2 — кюветы; 3 — ампула; 4 — масляный манометр; 5 — ртутный манометр; 6 — колба для хранения газа; 7 — кран; S — калиброванная колба;
9 — лампа термопары
Нения давления при адсорбции. Измерения проводят следующим образом.
Сначала установку, полностью подготовленную к работе, подсоединяют к вакуумной линии для «тренировки». Затем колбу 6 наполняют азотом. Для этого к крану 1 присоединяют трубку, конец которой опущен в жидкий азот. Используя известный объем калиброванной колбы и применяя закон Бойля—Мариотта (измерение проводят отдельно для каждой кюветы), измеряют адсорбционный объем системы и замеряют давление Рг (Рх должно примерно составлять 16 кПа) газа в системе при открытом кране 7, затем кран 7 закрывают и откачивают газ, далее вновь открывают кран 7 (при этом остальные краны ставят в такое положение, чтобы азот, находящийся в колбе 8, переходил только в измерительный объем) и фиксируют давление газа Р2. По значениям Р1У Р2 и известному объему колбы 8 (ог) вычисляют искомый объем о2:
Далее градуируют масляный манометр по ртутному и определяют поправку на охлаждение газа в кювете. Для нахождения этой поправки в зависимости от навески адсорбента загружают в каждую кювету определенное число стеклянных шариков или палочек. Затем систему снова вакуумируют, подают азот до давления 16 кПа, все кюветы, кроме одной, отключают, замеряют давление и погружают эту кювету в жидкий азот. После того, как давление стабилизируется, вычисляют коэффициент охлаждения і
Здесь Р — давление азота в системе; ДР — изменение давления после погружения кюветы в жидкий азот (после адсорбции).
Такие измерения проводят для каждой кюветы, и строят график зависимости коэффициента охлаждения от навески акат.
При непосредственном измерении удельной площади поверхности берут навеску исследуемого материала из такого расчета, чтобы ее суммарная поверхность была 5—100 м2. Все заполненные навесками кюветы ставят в рабочее положение, для чего соединяют их с вакуумной линией и создают необходимый вакуум при обогреве до 200—250 °С. Затем отключают насос и обогрев. После остывания кюветы соединяют с измерительной системой. Далее из колбы с азотом подают газ с таким расчетом, чтобы давление его в системе стало 16 кПа, отключают от системы все кюветы, кроме одной, замеряют показания манометра и кювету погружают в сосуд Дьюара с жидким азотом. После того, как положение уровня жидкости в манометре установится, снова замеряют давление.
Удельную площадь поверхности катализатора рассчитывают по формуле:
5уд = А (АР — іР)/(пакат). (5.18)
Здесь А — постоянная’для данного объема системы, равная 4,4 vsj ^ 1 +
+ тг^Л 760; 4,4 — площадь поверхности адсорбента, [которую занимает 1 см3 2*10 J
Газообразного азота при нормальных условиях, м2/см3; v — объем системы, в которой проводят адсорбцию, см3; В — коэффициент пересчета показаний масляного манометра на ртутный; t — температура помещения, °С; п = w/wM.
Записав уравнение БЭТ (5.13) в ином виде, можно определить значение п:
Параметр с рассчитывают по формуле (5.14); при температуре жидкого азота с « 240.
Хроматографический метод определения поверхности имеет ряд преимуществ по сравнению со статическими: хроматографические установки не требуют вакуумной аппаратуры; они значительно проще в монтаже; само определение занимает гораздо меньше времени, являясь при этом более чувствительным (можно определять площадь поверхности в 0,01 м2/г).
Сущность метода заключается в том, что из смеси адсорбата с газом-носителем производят поглощение адсорбата при охлаждении образца адсорбента до температуры жидкого азота. Это временно приводит к уменьшению концентрации адсорбата в смеси, проходящей через измерительную ячейку катарометра, что регистрируется потенциометром и фиксируется на диаграмме самописца в виде адсорбционного пика. По достижении равновесия в системе катализатор—газ перо самописца возвращается в прежнее положение. При комнатной температуре образца концентрация адсорбата в смеси в результате десорбции временно возрастает, и это изменение дает на диаграмме десорбционный пик, направленный в противоположную сторону от нулевой линии катарометра (детектор по теплопроводности) по отношению к ад-
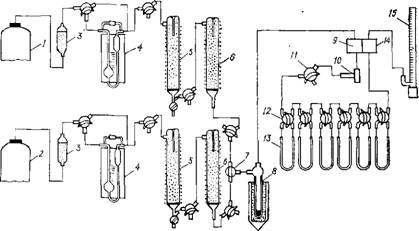
Рис. 5.7. Установка для определения площади поверхности катализатора хроматографи-
1,2 — баллоны для адсорбата и газа-носителя соответственно; 3 — фильтры со стеклянной ватой; 4 — реометры; 5 — колонки для очистки газов; 6 — осушительные колонки; 7, 11 — трехходовые краны; S — ловушка; 9 — ячейка катарометра; 10 — приспособление для ввода пробы в систему; 12 — четырехходовой кран; 13 — адсорбер; 14 — измерительная ячейка катарометра; 15 — измеритель скорости адсорбции
Сорбционному пику. Площадь адсорбционного пика на хромато — грамме пропорциональна количеству адсорбированного адсорбата. При этом площади адсорбционного и десорбционного пиков будут равны. Часто адсорбционный пик получается «размытым», что затрудняет измерение его площади. Поэтому на практике обычно используют площадь более четкого десорбционного пика.
Выбор адсорбата имеет большое значение во всех адсорбционных методах, в том числе и в хроматографическом. Желательно, чтобы площадь молекулы адсорбата в монослое на поверхностях разной химической природы была постоянной. Кроме того, важно, чтобы при температуре опыта химическая адсорбция отсутствовала. Лучше всего этим тоебованиям отвечают инеотные газы и азот [221, 222].
При выборе газа-носителя следует руководствоваться в основном следующим: адсорбция газа-носителя при температуре опыта (температура жидкого азота) должна быть настолько мала, чтобы ею можно было пренебречь; коэффициенты теплопроводности газа — носителя и адсорбата должны сильно различаться между собой для обеспечения высокой чувствительности катарометра, действие которого основано на том, что нагретое тело теряет теплоту со скоростью, зависящей от состава окружающего газа. Поэтому скорость теплоотдачи может быть использована для определения состава газа [20, 51].
Установка для определения площади поверхности катализатора хроматографическим методом (рис. 5.7) состоит из системы очистки газов, дозировочных устройств, адсорбентов и измерительной части (хроматографа).
Газ-носитель и адсорбат из баллонов 1, 2 поступают в фильтры со стеклянной ватой 3 для очистки от следов масла, проходят реометры 4 и очистительную систему. При использовании гелия высокой чистоты (99,9 % Не) и аргона сорта А (99,99 % Аг) можно обойтись без предварительной очистки, оставив только ловушку 8 для вымораживания влаги из газовой смеси. Азот и водород необходимо затем очищать от кислорода на хромоникелевом катализаторе в колонках 5 и осушать в колонках 6. Очищенные газы смешивают в трехходовом кране 7, и далее смесь последовательно проходит сравнительную ячейку катарометра 9, приспособление 10 для ввода пробы в систему при калибровке, шесть адсорберов 13, отделяемых друг от друга четырехходовыми кранами 12, измерительную ячейку катарометра 14 и измеритель скорости адсорбции 15.
Образование мономолекулярного слоя адсорбата на катализаторе достигается выбором определенных соотношений газов в исходной смеси. Так, при работе с азотом его относительное парциальное давление в используемой газовой смеси должно быть в пределах 0,1-^-0,3. Если парциальное давление азота будет большим, то образуется полимолекулярный слой и при расчетах получаются завышенные результаты; если давление меньше, то не вся поверхность катализатора окажется покрытой молекулами азота.
Перед измерением площади поверхности катализатора прибор градуируют и определяют градуировочный коэффициент Z (см^см2). После проведения эксперимента значение 5УД рассчитывают с учетом того, что площадь одной молекулы, например азота, в плотном монослое составляет 1,62 нм2:
Здесь 5П — площадь пика, см2; f — масштабный коэффициент.
Погрешность расчета по приведенной формуле (не превышает ±5 %.
Чтобы получить более полную информацию о свойствах катализатора, важно измерить площадь поверхности отдельных компонентов катализатора, например активных оксидов металлов [20, 51]. С этой целью применяют хемосорбционные методы, основанные на различной адсорбции некоторых газов или паров компонентами катализатора. Так, при использовании низкотемпературной адсорбции оксида углерода оценена поверхность никеля, нанесенного на оксид алюминия. Химической адсорбцией кислорода определяется поверхность платины на сульфате бария [51 ].
В настоящее время методы раздельного определения площади поверхности компонентов все больше входят в практику исследования контактных масс и являются весьма перспективными.
🌟 Видео
Влияние площади поверхности соприкосновения веществ на скорость химической реакции.Скачать

Стереометрия первая часть профильного ЕГЭ по математике, задания реальных экзаменов прошлых лет.Скачать

Влияние размеров поверхности соприкосновения реагирующих веществ на скорость химических реакцийСкачать

Каталитический риформинг (Объяснение ППБ-79. Простым языком о сложном)Скачать

Прямоугольный параллелепипед. Площадь поверхности прямоугольного параллелепипедаСкачать

Площадь поверхности куба. 5 кл.ЕГЭ(базовый уровень)Скачать
Как устроен Катализатор?/ Рассказываем о Выхлопных СистемахСкачать

Как найти площадь поверхности фигуры? How find surface area of figure?Скачать
Площадь прямоугольника. Как найти площадь прямоугольника?Скачать

Скорость химической реакции (задание №18 ЕГЭ по химии) | Химия ЕГЭ для 10 класса | УмскулСкачать

Площадь полной поверхности призмыСкачать