Видео:Самый четкий снимок атомов в историиСкачать

Азбука квантовых вычислений: 35 терминов, которые помогут разобраться в технологии
Квантовые вычисления неспроста считают самым перспективным направлением из всех квантовых технологий: именно они подарят миру квантовый компьютер, а с ним — производство новых материалов и лекарственных средств и возможность решать оптимизационные задачи в тысячи раз быстрее, чем это возможно сегодня. Руководитель научной группы «Квантовая поляритоника» Российского квантового центра и профессор Саутгемптонского университета Алексей Кавокин специально для «Хайтека» разобрал основные термины и явления из области квантовых вычислений.
Читайте «Хайтек» в
Алгоритм в квантовых вычислениях — набор операций, которые надо совершить, чтобы решить задачу на квантовом компьютере. Информация вводится в квантовый компьютер в виде последовательности нулей и единиц: битов информации. Однако в процессе вычисления квантовый компьютер оперирует смешанными состояниями — кубитами, в каждом из которых есть часть нуля и часть единицы. Именно поэтому квантовые алгоритмы отличаются от классических. В конце вычисления квантовое измерение снова делает последовательность нулей и единиц.
Борьба с декогеренцией — один из методов коррекции ошибок вычислений, производимых квантовыми компьютерами. Чем эффективнее борьба, тем более достоверными будут результаты работы квантовых алгоритмов.
Волновая функция — функция, которая используется в квантовой механике для описания так называемого «чистого состояния системы». Она задает вероятность нахождения системы в том или ином состоянии. Квантовое измерение приводит к коллапсу волновой функции: вероятности всех состояний, кроме одного, обращаются в ноль.
Геометрия, квантовая — метод описания объектов, размер которых настолько мал, что такие классические понятия, как траектория и скорость, к ним уже не применимы.
Декогеренция — процесс нарушения когерентности (постоянства разности фаз волновых функций — «Хайтек») кубитов в результате взаимодействия системы с окружающей средой. Другими словами, декогеренция — возникновение запутанности между квантовой системой и окружением. Именно она является источником ошибок в ходе вычислений. Чтобы замедлить ее, необходимо изолировать кубиты и снизить влияние внешних факторов. На практике это реализуется, например, охлаждением кубитов до сверхнизких температур.
Емкость, квантовая — величина, которая определяется как изменение электрического заряда относительно изменения электрохимического потенциала. Квантовую емкость еще называют химической или электрохимической емкостью.
Жидкость, квантовая — это жидкость, свойства которой определяются квантовыми эффектами. Примером квантовой жидкости является сверхтекучий гелий-II — жидкость с нулевой вязкостью. Сверхтекучий гелий проникает в сколь угодно узкие капилляры.
Замок, квантовый — конфигурация магнитного поля, фиксирующая предмет в трехмерном пространстве. Наиболее яркий пример: левитация постоянного магнита над сверхпроводником за счет выталкивания магнитного поля сверхпроводником. Эффект применяется в поездах на магнитной подушке, таких, как самый быстрый поезд в мире MAGLEV, перевозящий пассажиров из аэропорта Шанхая в центр города.
Ионы — электрически заряженные частицы, образуются в результате потери или присоединения электронов к атому или молекуле. Если заряд положительный, ион называют катионом, если отрицательный — анионом.
Квантовые компьютеры — вычислительные устройства, которые используют явление квантовой суперпозиции состояний для передачи и обработки данных. Логические операции в квантовых компьютерах проводятся с помощью кубитов, принимающих бесконечное множество значений, в отличие от битов классического компьютера, принимающих лишь два возможных значения: «0» и «1». Квантовая интегральная схема позволяет проводить операции над всеми возможными состояниями системы одновременно, существенно увеличивая скорость проведения операций. Это позволяет квантовым компьютерам решать задачи, связанные с выбором одного решения из множества, гораздо более эффективно, чем это делают классические компьютеры.
Кубит — квантовый аналог транзистора. Это наименьший элемент для хранения информации в квантовом компьютере. Если транзистор хранит классический бит информации, который принимает значения «0» или «1», то кубит хранит квантовый бит информации, значение которого может быть произвольной линейной комбинацией из «0» и «1».
Квазичастица — квант электронного возбуждения в кристалле. Наиболее известные квазичастицы — электроны и дырки, переносят электрический заряд в полупроводниковых транзисторах. Электрон-квазичастица отличается от электрона — элементарной частицы массой: он гораздо легче. Эффективная масса квазичастицы определяется свойствами кристалла. Кванты света, фотоны, проходя через кристалл, образуют квазичастицы «жидкого света» — поляритоны. Плазмоны, фононы, магноны, экситоны — это квазичастицы, описывающие разные виды колебаний в кристалле. Квазичастица никогда не выходит за пределы своего кристалла.
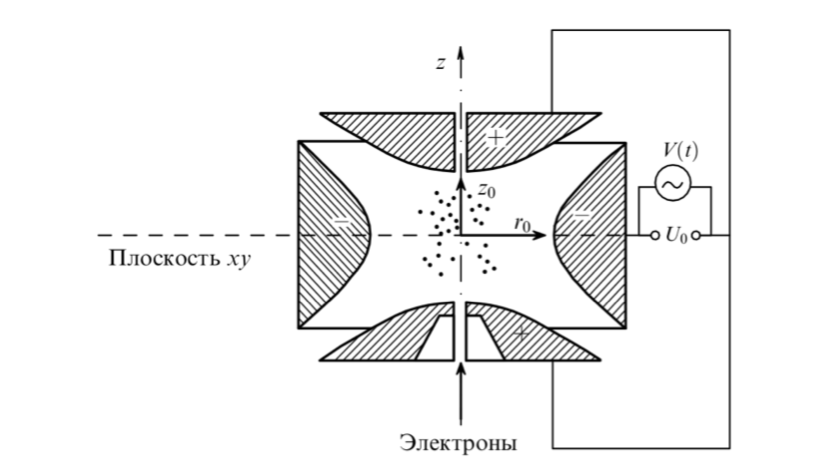
Ловушка Пауля — одна из разновидностей электромагнитных ловушек, предназначенная для удержания, замедления и хранения заряженных микрочастиц, в частности ионов, в течение определенного времени.
Матрица плотности — один из основных способов описания состояния квантовомеханической системы. Если волновая функция пригодна только для описания чистых состояний (см. чистое состояние системы), то матрица плотности пригодна для работы как с чистыми, так и смешанными состояниями, в том числе с перепутанными состояниями, которые важны для квантовых коммуникаций.
Механика, квантовая — раздел теоретической физики, описывающий физические явления в микромире. Квантовая механика была создана в начале XX века в ответ на несколько парадоксов, которые не могла объяснить классическая физика. До сих пор ведутся споры о философской интерпретации квантовой механики, некоторые положения которой противоречат материалистической картине мира.
Неопределенность в квантовых вычислениях — принцип, который гласит, что невозможно одновременно знать и точное положение, и точную скорость частицы. Так, если мы понимаем, где в данный момент находится частица, мы не можем определить ее скорость. Если мы знаем скорость, значит, не можем определить координаты. Принцип неопределенности сформулировал немецкий физик Вернер Гейзенберг.
Объем, квантовый — специализированная характеристика, которую ввела компания IBM для измерения «качества» квантовых компьютеров. Квантовый объем растет только при одновременном увеличении числа кубитов и уменьшении числа ошибок при работе над ними. А значит, недостаточно только повышать число кубитов — при сохранении количества ошибок объем расти не будет.
Оптика, квантовая — раздел оптики, который занимается изучением явлений, где явно проявляются квантовые свойства светового излучения, включая тепловое излучение и фотоэффект. Квантовая оптика основана на представлении о свете как о потоке квантов — фотонов.
Поляритон — квазичастица «жидкого света». Поляритоны возникают благодаря взаимодействию квантов света, фотонов, с возбужденными состояниями кристалла: экситонами, фононами, плазмонами или магнонами. Поляритоны сочетают свойства света со свойствами материальных частиц.
Превосходство — в квантовых вычислениях это способность квантовых компьютеров решать некоторые проблемы принципиально быстрее, чем любой классический компьютер. С увеличением сложности проблемы время, которое тратит на ее решение квантовый компьютер, растет существенно медленнее, чем время, которое потребуется для ее решения классическому компьютеру.
Радиация — распространение энергии в форме излучения. Часто под радиацией подразумевают ионизирующее излучение, которое может вызывать разрушение живых клеток. Недавно физики обнаружили, что радиация сокращает время когерентности квантовых состояний сверхпроводящих кубитов, а значит, квантовые компьютеры на сверхпроводниках должны должны будут обладать радиационной защитой.
Симулятор, квантовый — квантовая вычислительная система, нацеленная на решение одной или нескольких однотипных задач. Квантовые симуляторы способны имитировать свойства и поведение реальных квантовых систем. Их работа осуществляется без помощи механизма коррекции ошибок, что позволяет создавать симуляторы с помощью меньшего числа кубитов, чем то, которое понадобилось бы универсальному квантовому компьютеру.
Суперпозиция в квантовой теории — сочетание свойств различных квантовых состояний частицы (то есть состояний с разными энергиями или скоростями). Частица существует одновременно в двух или нескольких состояниях до тех пор, пока акт измерения не находит ее в одном из состояний. Так опытный игрок в прятки незаметно переходит из одной комнаты в другую, прячась везде одновременно до тех пор, пока его не обнаружат в одной из комнат.
Туннельный эффект — возможность преодоления микрочастицей потенциального барьера. Иллюстрацией к этому эффекту может быть колобок, который катится по ровной дороге и приближается к горке. В классическом мире колобок не сможет преодолеть достаточно высокую гору с разбега. В квантовой реальности у него есть возможность преодолеть препятствие в любом случае, как будто прорыв туннель под горой.
Тьюринг, Алан — выдающийся английский математик, создатель первого компьютера. Во время Второй Мировой войны он руководил группой ученых, создавших «бомбу Тьюринга» — вычислительную машину, взломавшую шифр немецкой криптографической системы «Энигма».
Универсальный квантовый компьютер — программируемый вычислительный прибор, основанный на использовании квантовых вычислительных алгоритмов. Его особенностью в отличие от квантового симулятора является необходимость использования квантовой процедуры коррекции ошибок. Это приводит к резкому росту числа кубитов в процессоре компьютера и делает реализацию такого процессора крайне сложной технической задачей.
Фотон — самая распространенная элементарная частица во Вселенной, квант электромагнитного излучения. Фотон переносит электромагнитное взаимодействие, не имеет массы и заряда, передвигается в вакууме с самый высокой из возможных скоростей — скоростью света. Фотоны можно представить себе в виде воздушных шариков, наполненных водой. Волны на поверхности воды несут информацию о частоте, фазе и поляризации света. Получить эту информацию можно лишь продырявив шарик, то есть уничтожив/поглотив фотон.
Хаос, квантовый — раздел физики, который изучает, как хаотические классические системы могут быть описаны с точки зрения квантовой механики. Система считается хаотической, если небольшое отклонение в ее начальном состоянии приводит к радикальным изменениям в ее последующей эволюции.
Цвет, квантовый. Это квантовое число, одна из характеристик кварков и глюонов, элементарных частиц. Квантовый цвет не имеет ничего общего с обычным цветом, то есть с длиной волны света.
Чистое состояние системы — состояние, которое можно описать волновой функцией. Как правило, чистые состояния живут недолго: они разрушаются за счет процессов декогерентности. Перепутанные квантовые состояния не являются чистыми.
Шредингер, Эрвин — австрийский ученый, один из отцов-основателей квантовой механики. Он предложил мысленный эксперимент, демонстрирующий парадоксальную нелепость принципа квантовой суперпозиции. В закрытый ящик помещается живой кот и устройство, состоящее из счетчика Гейгера с небольшим количеством радиоактивного вещества внутри, колбы с ядом и специального механизма. Вероятность того, что один из радиоактивных атомов распадется в течение часа, равна 50%. Распад атома должен повлечь за собой срабатывание механизма, который разбивает колбу с ядом. Как только колба оказывается разбита, кот умирает. Пока ящик закрыт, мы не знаем, жив кот или мертв. С точки зрения квантовой механики он одновременно и жив, и мертв. Только измерение (вскрытие ящика) проецирует квантовое состояние кота на классический базис: кот оказывается либо жив, либо мертв.
Эмулятор — это программа, которая позволяет воспроизводить свойства систем для квантовых вычислений на классических компьютерах. Благодаря эмуляторам мы можем исследовать потенциал технологии квантовых вычислений: демонстрировать алгоритмы, пробовать методы подавления ошибок и квантовые коды коррекции ошибок
Экситон — квазичастица, состоящая из двух других квазичастиц: положительно заряженной дырки и отрицательно заряженного электрона. Экситон имеет такую же структуру энергетических уровней, как атом водорода. В отличие от атомов водорода, экситоны нестабильны. Их время жизни, как правило, не превышает одной миллиардной доли секунды. Исчезая, экситоны передают свою энергию квантам света — фотонам.
Юнга опыт — эксперимент Томаса Юнга позволил продемонстрировать интерференцию и дифракцию света — явления, которые послужили доказательством справедливости волновой теории света. Впоследствии этот опыт был повторен для потока электронов. Измерения показали, что и свет, и материя могут проявлять свойства как волн, так и частиц.
Язык квантового программирования — особый язык программирования, который дает возможность описывать квантовые алгоритмы для решения различных задач. В настоящее время существует несколько языков квантового программирования, включая QPL, QCL, Haskell-подобный QML, Quipper, Q#, Q, qGCL, cQPL.
Видео:СТРОЕНИЕ АТОМА ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Строение атома. Модели атома. Атомные спектры
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Строение атома
- 2.1. Первые модели атома
- 2.2. Атомные спектры
- 2.3. Кванты и модель Бора
- 2.4. Двойственная природа электрона
- 2.5. Квантово – механическая модель атома
Первые модели атома.
В 1897 г. Дж. Томсон (Англия) открыл электрон, а в 1909г. Р. Малликен определил его заряд, который равен 1,6 · 10 -19 Кл. Масса электрона составляет 9,11 · 10 -28 г. В 1904 г. Дж. Томсон предложил модель строения атома, согласно которой атом можно представить в виде положительно заряженной сферы с вкрапленными электронами.
В 1910 г. в лаборатории Э. Резерфорда (Англия) в опытах по бомбардировке металлической фольги α – частицами было установлено, что некоторые α – частицы рассеиваются фольгой. Отсюда Резерфорд заключил, что в центре атома существует положительно заряженное ядро малого размера, окруженное электронами. Наличие положительного ядра в атоме получило подтверждение в дальнейших экспериментах. Радиусы ядер лежат в пределах 10 -14 – 10 -15 м, т.е. в 10 4 – 10 5 раз меньше размера атома. Резерфорд предсказал существование протона и его массу, которая в 1800 раз превышает массу электрона.
В 1910 г. Резерфорд предложил ядерную планетарную модель атома, состоящего из тяжелого ядра, вокруг которого двигаются по орбитам электроны, подобно планетам солнечной системы. Однако, как показывает теория электромагнитного поля, электроны в этом случае должны двигаться по спирали, непрерывно излучая энергию, и падать на ядро.
Атомные спектры.
При нагреве вещество испускает лучи (излучение). Если излучение имеет одну длину волны, то оно называется монохроматическим. В большинстве же случаев излучение характеризуется несколькими длинами волн. При разложении излучения на монохроматические компоненты получают спектр излучения, где отдельные его составляющие выражаются спектральными линиями. Спектры, получающиеся при излучении свободными или слабо связанными атомами (например, в газах или парах), называют атомными спектрами. Длины волн, соответствующие атомному спектру водорода, определяются уравнением Бальмера
Кванты и модель Бора.
В 1900 г. М. Планк (Германия) высказал предположение, что вещества поглощают и испускают энергию дискретными порциями, названными им квантами. Энергия кванта Е пропорциональна частоте излучения (колебания) ν:
В 1910 г. датский ученый Н. Бор, используя модель Резерфорда и теорию Планка, предложил модель строения атома водорода, согласно которой электроны двигаются вокруг ядра не по любым, а лишь по разрешенным орбитам, на которых электрон обладает определенными энергиями. При переходе электрона с одной орбиты на другую атом поглощает или испускает энергию в виде квантов. Каждая орбита имеет номер n (1,2,3,4, …), который назвали главным квантовым числом. Бор вычислил радиусы орбит. Радиус первой орбиты был 5,29 · 10 – 13 м, радиус других орбит был равен:
rn = n 2 (5,29 · 10 – 13 ) (3)
Энергия электрона (эВ) зависит от значения главного квантового числа n:
Отрицательный знак энергии означает устойчивость системы, которая тем более устойчива, чем ниже (чем более отрицательна) ее энергия. Атом водорода обладает минимальной энергией, когда электрон находится на первой орбите (n = 1). Такое состояние называется основным. При переходе электрона на более высокие орбиты атом становится возбужденным. Такое состояние атома неустойчиво. При переходе с верхней орбиты на нижнюю атом излучает квант света, что экспериментально обнаруживается в виде серий атомного спектра. Значения n и m в уравнении (1) соответствуют значениям главных квантовых чисел, с которых электрон переходит (т) и на которые электрон переходит (n).
Теория Бора позволила рассчитать энергию электронов, значения квантов энергии, испускаемых при переходе электрона с одного уровня на другой.
Теория Бора получила экспериментальное подтверждение. Однако она не смогла объяснить поведение электрона в магнитном поле и все атомные спектральные линии. Теория Бора оказалась непригодной для многоэлектронных атомов. Возникла необходимость в новой модели атома, основанной на открытиях в микромире.
Двойственная природа электрона.
В 1905 г. А. Эйнштейн предсказал, что любое излучение представляет собой поток квантов энергии, называемых фотонами. Из теории Эйнштейна следует, что свет имеет двойственную (корпускулярно-волновую) природу.
В 1924 г. Луи де Бройль (Франция) выдвинул предположение, что электрон также характеризуется корпускулярно-волновым дуализмом. Позднее это было подтверждено на опытах по дифракции на кристаллах. Де Бройль предложил уравнение, связывающее длину волны λ электрона или любой другой частицы с массой т и скоростью ν,
Волны частиц материи де Бройль назвал материальными волнами. Они свойственны всем частицам или телам. Однако, как следует из уравнения (5), для микротел длина волны настолько мала, что в настоящее время не может быть обнаружена. Так, для тела с массой 1000 кг, двигающегося со скоростью 108 км/ч (30 м/с) λ = 2,21 · 10 – 38 м.
В 1927 г. В. Гейзенберг (Германия) постулировал принцип неопределенности, согласно которому положение и импульс движения субатомной частицы (микрочастицы) принципиально невозможно определить в любой момент времени с абсолютной точностью. В каждый момент времени можно определить только лишь одно из этих свойств. Э. Шредингер (Австрия) в 1926 г. вывел математическое описание поведения электрона в атоме.
Работы Планка, Эйнштейна, Бора, де Бройля, Гейзенберга, а также Шредингера, предложившего волновое уравнение, заложили основу квантовой механики, изучающей движение и взаимодействие микрочастиц.
Квантово – механическая модель атома.
В настоящее время строение атома рассматривается с позиций квантовой или волновой механики, в основе которой лежит представление о двойственной природе электрона: электрон, как и любая частица микромира, обладает одновременно свойствами частицы (массой m и скоростью передвижения v) и свойствами волны (длиной волны ):
Волновая механика описывает движение электрона в атоме как распространение волны по всему объему атома. Каждое мгновение электрон может находиться в любой части пространства вокруг ядра.
Путь, описываемый электроном, сливается в расплывчатое электронное облако, в котором плотность отрицательного заряда соответствует вероятности обнаружения электрона.
Плотность электронного облака максимальна на некотором расстоянии от ядра и характеризует удаленность электрона от ядра и запас его энергии. Состояние электрона в атоме математически описывается волновым уравнением.
Представление об электронном облаке – это квантово-механическая модель электрона в атоме. Понятию «электронное облако» соответствуют также понятия «атомная орбиталь», «квантовая ячейка», «энергетическая ячейка». Электронные облака (атомные орбитали) могут быть разного размера, различной формы, по-разному ориентированы в пространстве. Все это соответствует определенному энергетическому состоянию электрона.
В многоэлектронных атомах все электроны распределяются по энергетическим уровням (электронным слоям или электронным оболочкам). В пределах энергетического уровня электроны распределяются по подуровням (подоболочкам). Полная характеристика каждого электрона определяется значениями четырех квантовых чисел. Многоэлектронный атом подчиняется принципу Паули (1925 г.): в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел:
1. Главное квантовое число (n) характеризует энергетический уровень и отражает размеры электронного облака. n принимает значения целых чисел 1, 2, 3, 4, 5, 6, 7… (или в буквенном изображении K, L, M, N, O, P, Q…). С увеличением n (удалением электрона от ядра) энергия электрона возрастает. Число энергетических уровней в невозбужденном атоме равно номеру периода, в котором находится элемент в периодической системе. Например, электроны атома натрия распределяются по трем уровням, которым соответствуют значения главного квантового числа n=1 (K), n=2 (L), n=3 (M).
2. Орбитальное квантовое число l характеризует энергетический подуровень и отражает форму электронного облака. Усложнение формы электронного облака связано с возрастанием энергии электрона. Орбитальное квантовое число может изображаться буквами s, p, d, f или цифрами, которые в пределах данного энергетического уровня (с данным значением n) могут принимать целочисленные значения от 0 до (n-1).
Для обозначения подуровня указывают цифрой главное квантовое число (т.е. обозначают, в каком уровне находится электрон и каков размер его электронного облака) и буквой указывают орбитальное квантовое число (т.е. характеризуют форму этого облака). например, подуровни 1s, 2s, 2p, 4s, 3d, 5f и т.д.
Таблица 5. Энергетические подуровни
Согласно пределам изменений орбитального квантового числа от 0 до (n-1), в каждом энергетическом уровне возможно строго ограниченное число подуровней, а именно: число подуровней равно номеру уровня:
| n | l | Обозначение подуровней | Число подуровней |
| 1 | 0 | 1s | один |
| 2 | 0, 1 | 2s, 2p | два |
| 3 | 0, 1, 2 | 3s, 3p, 3d | три |
| 4 | 0, 1, 2, 3 | 4s, 4p, 4d, 4f | четыре |
Сочетание главного (n) и орбитального (l) квантовых чисел полностью характеризует энергию электрона. Запас энергии электрона отражается суммой (n+l).
Так, например, электроны 3d-подуровня обладают более высокой энергией, чем электроны 4s-подуровня:
Порядок заполнения уровней и подуровней в атоме электронами определяется правилом В.М. Клечковского: заполнение электронных уровней атома происходит последовательно в порядке возрастания суммы (n+1).
В соответствии с этим определена реальная энергетическая шкала подуровней, по которой построены электронные оболочки всех атомов:
3. Магнитное квантовое число (ml ) характеризует направление электронного облака (орбитали) в пространстве.
Чем сложнее форма электронного облака (т.е. чем выше значение l), тем больше вариаций в ориентации данного облака в пространстве и тем больше существует отдельных энергетических состояний электрона, характеризующихся определенным значением магнитного квантового числа.
Математически ml принимает целочисленные значения от -1 до +1, включая 0, т.е. всего (21+1) значений.
Обозначим каждую отдельную атомную орбиталь в пространстве как энергетическую ячейку , тогда число таких ячеек в подуровнях составит:
Например, шарообразная s-орбиталь однозначно направлена в пространстве. Гантелеобразные орбитали каждого p-подуровня ориентируются по трем осям координат
4. Спиновое квантовое число ms характеризует собственное вращение электрона вокруг своей оси и принимает всего два значения: + 1 /2 и – 1 /2, в зависимости от направления вращения в ту или другую сторону. Согласно принципу Паули, в одной орбитали может расположиться не более 2 электронов с противоположно направленными (антипараллельными) p- подуровень спинами:.
Такие электроны называются спаренными.
Неспаренный электрон схематически изображается одной стрелкой:.
Зная емкость одной орбитали (2 электрона) и число энергетических состояний в подуровне (ms), можно определить количество электронов в подуровнях:
| Подуровень | Число орбиталей | Число электронов в подуровне |
| S | 1 | 2 |
| P | 3 | 6 |
| D | 5 | 10 |
| F | 7 | 14 |
Можно записать результат иначе: s 2 p 6 d 10 f 14 .
Эти цифры необходимо хорошо запомнить для правильного написания электронных формул атома.
Итак, четыре квантовых числа – n, l, ml, ms – полностью определяют состояние каждого электрона в атоме. Все электроны в атоме с одинаковым значением n составляют энергетический уровень, с одинаковыми значениями n и l – энергетический подуровень, с одинаковыми значениями n, l и ml – отдельную атомную орбиталь (квантовую ячейку). Электроны одной орбитали отличаются спинами.
Учитывая значения всех четырех квантовых чисел, определим максимальное количество электронов в энергетических уровнях (электронных слоях):
| Уровень | Подуровни | Количество электронов | ||
| по подуровням | суммарное | |||
| K | n=1 | s | s 2 | 2 |
| L | n=2 | s, p | s 2 p 6 | 8 |
| M | n=3 | s, p, d | s 2 p 6 d 10 | 18 |
| N | n=4 | s, p, d, f | s 2 p 6 d 10 f 14 | 32 |
Большие количества электронов (18,32) содержатся только в глубоко лежащих электронных слоях атомов, внешний электронный слой может содержать от 1 (у водорода и щелочных металлов) до 8 электронов (инертные газы).
Важно помнить, что заполнение электронами электронных оболочек происходит по принципу наименьшей энергии: сначала заполняются подуровни с минимальным значением энергии, затем с более высокими значениями. Эта последовательность соответствует энергетической шкале подуровней В.М. Клечковского.
Электронную структуру атома отображают электронные формулы, в которых указываются энергетические уровни, подуровни и число электронов в подуровнях.
Например, у атома водорода 1H всего 1 электрон, который располагается в первом от ядра слое на s-подуровне; электронная формула атома водорода 1s 1 .
У атома лития 3Li всего 3 электрона, из них 2 находятся в s-подуровне первого слоя, а 1 помещается во второй слой, который также начинается s-подуровнем. Электронная формула атома лития 1s 2 2s 1 .
Атом фосфора 15P имеет 15 электронов, расположенных в трех электронных слоях. Помня, что s-подуровень содержит не более 2 электронов, а p-подуровень содержит не более 6, постепенно размещаем все электроны по подуровням и составляем электронную формулу атома фосфора: 1s 2 2s 2 2p 6 3s 2 3p 3 .
При составлении электронной формулы атома марганца 25Mn необходимо учесть последовательность возрастания энергии подуровней: 1s2s2p3s3p4s3d…
Распределяем постепенно все 25 электронов Mn: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 .
Окончательная электронная формула атома марганца (с учетом удаленности электронов от ядра) выглядит так:
Электронная формула марганца полностью соответствует положению его в периодической системе: число электронных слоев (энергетических уровней) – 4 равно номеру периода; во внешнем слое 2 электрона, предпоследний слой не завершен, что характерно для металлов побочных подгрупп; общее количество подвижных, валентных электронов (3d 5 4s 2 ) – 7 равно номеру группы.
В зависимости от того, какой из энергетических подуровней в атоме –s-, p-, d- или f- застраивается в последнюю очередь, все химические элементы подразделяются на электронные семейства: s-элементы (H, He, щелочные металлы, металлы главной подгруппы 2-й группы периодической системы); p-элементы (элементы главных подгрупп 3, 4, 5, 6, 7, 8-й групп периодической системы); d-элементы (все металлы побочных подгрупп); f- элементы (лантаноиды и актиноиды).
Электронные структуры атомов являются глубоким теоретическим обоснованием структуры периодической системы, длина периодов (т.е. количество элементов в периодах) непосредственно вытекает из емкости электронных слоев и последовательности возрастания энергии подуровней:
Каждый период начинается s-элементом со структурой внешнего слоя s 1 (щелочной металл) и заканчивается p-элементом со структурой внешнего слоя …s 2 p 6 (инертный газ). I-й период содержит только два s-элемента (H и He), II-й и III-й малые периоды содержат по два s-элемента и шесть p-элемента. В IV-м и V-м больших периодах между s- и p-элементами «вклиниваются» по 10 d-элементов – переходных металлов, выделенных в побочные подгруппы. В VI и VII периодах к аналогичной структуре добавляется еще по 14 f-элементов, по свойствам близких соответственно лантану и актинию и выделенных в виде подгрупп лантаноидов и актиноидов.
При изучении электронных структур атомов обратите внимание на их графическое изображение, например:
применяют оба варианта изображения: а) и б):
Для правильного расположения электронов на орбиталях необходимо знать правило Гунда: электроны в подуровне располагаются так, чтобы их суммарный спин был максимальным. Иными словами, электроны прежде по одному занимают все свободные ячейки данного подуровня.
Например, если необходимо разместить три p-электрона (p 3 ) в p-подуровне, который всегда имеет три орбитали, то из двух возможных вариантов правилу Гунда отвечает первый вариант:
В качестве примера рассмотрим графическую электронную схему атома углерода:
Количество неспаренных электронов в атоме – очень важная характеристика. Согласно теории ковалентной связи, только неспаренные электроны могут образовывать химические связи и определяют валентные возможности атома.
Если в подуровне имеются свободные энергетические состояния (незанятые орбитали), атом при возбуждении «распаривает», разъединяет спаренные электроны, и его валентные возможности повышаются:
Углерод в нормальном состоянии 2-х-валентен, в возбужденном – 4-х-валентен. Атом фтора не имеет возможностей для возбуждения (т.к. все орбитали внешнего электронного слоя заняты), поэтому фтор в своих соединениях одновалентен.
Пример 1. Что такое квантовые числа? Какие значения они могут принимать?
Решение. Движение электрона в атоме имеет вероятностный характер. Околоядерное пространство, в котором с наибольшей вероятностью (0,9-0,95) может находиться электрон, называется атомной орбиталью (АО). Атомная орбиталь, как любая геометрическая фигура, характеризуется тремя параметрами (координатами), получившими название квантовых чисел (n, l, ml). Квантовые числа принимают не любые, а определенные, дискретные (прерывные) значения. Соседние значения квантовых чисел различаются на единицу. Квантовые числа определяют размер (n), форму (l) и ориентацию (ml) атомной орбитали в пространстве. Занимая ту или иную атомную орбиталь, электрон образует электронное облако, которое у электронов одного и того же атома может иметь различную форму (рис. 1). Формы электронных облаков аналогичны АО. Их также называют электронными или атомными орбиталями. Электронное облако характеризуется четырьмя числами (n, l, m1 и m5).
Таблица 6. Значения квантовых чисел и максимальное число электронов на квантовых уровнях и подуровнях
| Квантовый | Магнитное квантовое число ml | Число квантовых состояний (орбиталей) | Максимальное число электронов | |||||
| уровень | подуровень | |||||||
| обозна чение | уровень главное квантовое число n | обозначение | орбитальное квантовое число l | |||||
| в подуровне (2l+1) | в уровне n 2 | в подуровне 2(2l+1) | в 2п 2 | |||||
| К | 1 | s | 0 | 0 | 1 | 1 | 2 | 2 |
| L | 2 | s | 0 | 0 | 1 | 2 | ||
| р | 1 | -1;0;+1 | 3 | 4 | 6 | 8 | ||
| М | 3 | s | 0 | 0 | 1 | 2 | ||
| р | 1 | -1;0;+1 | 3 | 9 | 6 | 18 | ||
| d | 2 | -2;-1; 0+1;+2 | 5 | 10 | ||||
| N | 4 | s | 0 | 0 | 1 | 2 | ||
| р | 1 | -1,0;+1 | 3 | 6 | ||||
| d | 2 | -2;-1;0;+1;+2 | 5 | 16 | 10 | 32 | ||
| f | 3 | -3;2;-1; 0;+1;+2;+3 | 7 | 14 | ||||
Эти квантовые числа связаны с физическими свойствами электрона, и число n (главное квантовое число) характеризует энергетический (квантовый) уровень электрона; число l (орбитальное) – момент количества движения (энергетический подуровень), число ml (магнитное) – магнитный момент, ms – спин. Спин электрона возникает за счет вращения его вокруг собственной оси. Электроны в атоме должны отличаться хотя бы одним квантовым числом (принцип Паули), поэтому в АО могут находиться не более двух электронов, различающихся своими спинами ms = ± 1 /2. В табл. 6 приведены значения и обозначения квантовых чисел, а также число электронов на соответствующем энергетическом уровне и подуровне.
Видео:Лучшая модель атома? [Минутка физики]Скачать
![Лучшая модель атома? [Минутка физики]](https://i.ytimg.com/vi/eybcxXiYJfc/0.jpg)
Типы химической связи в кристаллах
Деление химической связи на виды носит условный характер.
Для металлической связи, обусловленной притяжением электронов и ионов металлов, характерны некоторые признаки ковалентной, если принять во внимание перекрывание атомных орбиталей атомов. В образовании водородной связи, помимо электростатического взаимодействия, не последнюю роль играет донорно-акцепторный характер взаимодействия.
Резкую границу между ионной и ковалентной полярной связью также провести невозможно. Отнести любую связь металл-неметалл к ионному типу нельзя. Принято считать ионной связь между атомами, разность электроотрицательности которых больше или равна 2 (по шкале Полинга). Например, в оксиде натрия связь Na2O (3,44 – 0,93 = 2,51) связь ионная, а в бромиде магния MgBr ковалентная полярная связь (2,96 – 1,31 = 1,65).
В реальных веществах все типы химической связи в чистом виде не встречаются. У большинства соединений тип связи носит промежуточный характер. Это возможно, так как природа химической связи едина – это электростатическое взаимодействие электронов и ядер внутри и между атомами, сближенными на расстояние, когда возникает эффективное перекрывание электронных оболочек.
Поэтому возможен непрерывный переход между всеми предельными случаями: ионной, ковалентной, металлической и остаточной связью. Наглядно переход может быть представлен в виде тетраэдра, в вершинах которого помещены крайние представители, по ребрам переходы между двумя типами, а на гранях и внутри объема тетраэдра – сложные смешанные типы связи.
Эффективные радиусы атомов и ионов
Под эффективными радиусами атомов и ионов понимают радиусы действия сфер атомов или ионов, то есть минимальные расстояния, на которых центры сфер атомов или ионов могут приблизиться к поверхности соседних атомов.
Для определения эффективного радиуса атома или иона структуру кристалла представляют в виде соприкасающихся шаров, расстояние между которыми равно сумме их радиусов. В зависимости от типа химической связи между структурными единицами кристалла различают: металлические радиусы, ионные радиусы, ковалентные радиусы и Ван-дер-ваальсовы радиусы.
Металлические радиусы
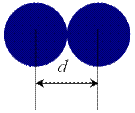
Определяется как половина расстояния между соседними атомами, полученного в результате рентгеноструктурного анализа:
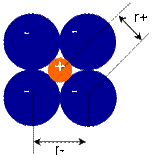
Ионные радиусы
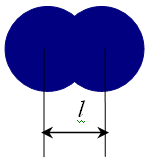
Для вычисления радиусов ионов исходят из предположения, что при достаточно большой разнице в размерах катионов и анионов большие по размеру анионы будут соприкасаться, а меньшие по размеру катионы будут располагаться в пустотах между анионами, тогда радиус аниона будет равен: 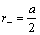
радиус катиона равен: 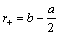
Ковалентные радиусы
Ковалентные радиусы определяются как половина межатомного расстояния (длины связи): 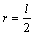
Кроме того, при расчете ковалентного радиуса учитывается способность некоторых элементов образовывать кратные связи, уменьшающие расстояния между атомами и тип гибридизации центрального атома.
Ван-дер-ваальсовы радиусы рассчитываются для атомов, которые связаны друг с другом только силами межмолекулярного взаимодействия. Рассчитываются как половина расстояния между центрами атомов: 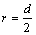
Поскольку методики расчета атомных и ионных радиусов различны, существует большое число таблиц радиусов.
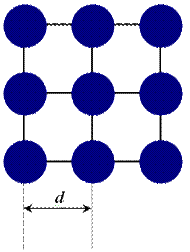
Ионные кристаллы
Объединение катионов и анионов в кристалл осуществляется благодаря кулоновскому притяжению электрических зарядов. В молекуле 
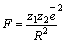
В ионных кристаллах нет молекул, поэтому не существует границ между структурными единицами. Ионы можно представить как заряженные шары, силовые поля которых равномерно распределяются во всех направлениях в пространстве. Поэтому каждый ион может притягивать к себе ионы противоположного знака в любом направлении, поэтому ионная связь не обладает направленностью.
Взаимодействие двух ионов противоположного знака не может привести к полной взаимной компенсации их силовых полей. В силу этого у них сохраняется способность притягивать ионы противоположного знака и по другим направлениям. Следовательно, ионная связь не является насыщенной.
Катионы стремятся себя окружить как можно большим числом анионов так, что кулоновское отталкивание ионов одного знака друг от друга компенсируется взаимным кулоновским притяжением катионов и анионов. Поэтому для структур с ионным типом химической связи характерны высокие координационные числа и плотнейшие шаровые упаковки. Симметрия ионных кристаллов обычно высокая.
Кристаллические вещества с ионным типом химической связи характеризуют диэлектрические свойства, хрупкость, средние значения твердости и плотности, низкая тепло- и электропроводность.
Энергия кристаллической решетки ионного кристалла – это энергия взаимодействия между всеми её ионами, она равна по величине и обратна по знаку энергии, которую необходимо затратить, чтобы разрушить кристаллическую структуру, то есть развести ионы на бесконечные расстояния.
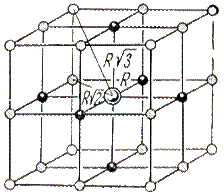 |
| Рис. 2.2. Схема структуры хлорида натрия |
Энергия решетки равна работе, которая совершается при сведении ионов из бесконечности в кристаллическую структуру:
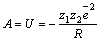
Расчет энергии решетки рассмотрим на примере. В ионном кристалле со структурой типа NaCl каждый ион окружен шестью ионами противоположного знака на расстоянии 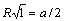
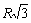
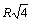
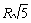
🔍 Видео
Что такое атом?Скачать

БЕЗ ЭТОГО НЕ СДАТЬ ЕГЭ по Химии — Электронная конфигурация атомаСкачать

Какие атомы на ощупь?Скачать

Строение атома. Объяснение электрических явлений | Физика 8 класс #10 | ИнфоурокСкачать

Из чего состоит атом? Просто о сложном.Скачать

Как устроен Атом? Из чего он состоит? Наука. Физика.Скачать

Ученые в панике. Что, если Вселенная - атом?Скачать

Строение атома. Опыты РезерфордаСкачать

Можно ли увидеть атомы по отдельности?Скачать

Разрезаем атомы. ФизикаСкачать

Видеоролик - анимация "Строение атома и ядра"Скачать

Как мы поняли, как выглядит атом на самом деле?Скачать

ЭЛЕКТРИЧЕСКИЙ ЗАРЯД — Как Устроен Атом, Что такое Ион? // Физика 8 классСкачать

Атомы: что внутри?Скачать

Мобильный атом | Техногеника 3 | Discovery ChannelСкачать

Строение атома | ЕГЭ по химии | #shortsСкачать

Энергетические уровни атома (видео 6) | Квантовая физика | ФизикаСкачать